遺伝子の連鎖と遺伝子地図
背景
Gregor Mendel はエンドウにおけるそれぞれ対照的な形質 7 種類の遺伝について分析した。 彼は,二因子雑種交雑,すなわち 2 つの異なる形質を制御する対立遺伝子が ヘテロ接合体 である形質の遺伝様式を分析した。
例
二因子雑種の作出 (F1)
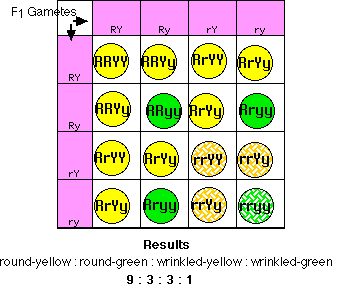
彼は丸種 ( RR ) で黄色 ( YY ) の種子をもつ 純系 (すなわち, ホモ接合体 homozygous ) の品種に,シワ種 ( rr ) で緑色 ( yy ) の種子をもつ品種を交雑した。この交雑によるすべての後代 (F1) は二因子雑種,すなわち各 対立遺伝子 がそれぞれ ヘテロ接合体 heterozygous ( RrYy )となる。 さらに,すべての種子は丸種で黄色となり,丸種と黄色の遺伝子が 優性 dominant であることを示す。
二因子雑種を交雑して F2 世代を作出する
その後,Mendel はこれらの二因子雑種を交雑した。交雑の結果,2 つの形質( 色と種子形状)のあらゆる組み合わせを示す種子が生じた。
- 9/16 丸種で黄色
- 3/16 丸種で緑色
- 3/16 シワ種で黄色
- 1/16 シワ種で緑色
彼が選んだ7つの形質がそれぞれ独立に分離して遺伝した。彼はこれをの第 2 法則,独立の法則とした。
1 対の因子(遺伝子)の遺伝は,別の遺伝子対の遺伝と独立している。
この法則は,以下の2つの条件が満たされた時に成立する:
- 遺伝子が異なる染色体にある場合,または
- 遺伝子が同一の染色体上にあっても,それぞれの遺伝子座がかなり離れている場合。
Mendel は非常に幸運であった。彼が研究した遺伝子のすべての対が,このいずれかの条件に当てはまっていた。表には, Mendel が研究した 7 種類の対立遺伝子の染色体番号を示す。
これらの遺伝子のすべてが 独立組み合わせ の条件を満たすが,事実,7 種類の遺伝子のうち,第 4 染色体に 3 種類の遺伝子座が,また第 1 染色体上に 2 種類の遺伝子座が位置していた。しかし,それらの遺伝座が十分に離れていたために,異なる染色体上にあるような遺伝の仕方が起こったのである。
Mendel の法則が再発見されて以来,彼の第 2 法則が多くの二因子雑種に適応できない例外が次々に発見された。それらの多くは,一方の親から 2 つの対立遺伝子が受け継がれる傾向が強く,両遺伝子が同じ染色体に位置している例であった。
連鎖の例
2 つの異なる系統のトウモロコシの例を見てみよう:
- 2 つの形質に対してホモ接合体の系統
- 黄色の穀粒 (C, C) は内胚乳で満たされ,
- 表面は平滑 (Sh, Sh)。
- それどれがヘテロ接合体の他の系統
- 無色の穀粒 (c, c) で内胚乳が収縮したため,
- 表面は収縮してシワ (sh, sh)。
それぞれの系統同士を交配すると, (F1) の穀粒はすべて黄色で平滑である。したがって,黄色の遺伝子 ( C ) と平滑 ( Sh ) の遺伝子は,それぞれ無色 ( c ) とシワ( sh )に対して優性である。
分析を簡単にするために,二因子雑種を 劣性ホモ接合体 の系統 ( ccshsh ) と交配する。評価したい系統におけるすべての配偶子の 遺伝子型 が判明するので,このような交配を 検定交配 と呼ぶ。
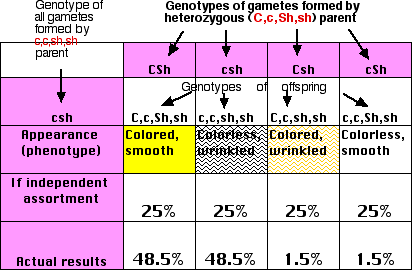
Mendel の第 2 法則によると,内胚乳の色を決定する遺伝子は穀粒の形状の遺伝子と独立に遺伝するはずである。 F1 はほぼ均等の配偶子を生産する。
- CSh, 一方の親から受け継ぐ
- csh, 他方の親から受け継ぐ
- CSh, 乗り換え
- cSh, 別の乗り換え
2 つとも劣性ホモの個体によって生産される配偶子はすべて csh である。
これらの遺伝子の遺伝が Mendel の第 2 の法則,すなわち独立の法則に従うとすると,これらの配偶子の結合によって ほぼ同じ数 の 4 種類の 表現型 を示す個体が生産されるはずである。しかし表が示すように,親の対立遺伝子が連鎖する傾向がある。これは,2 つの遺伝子座が比較的接近しているために生じる。配偶子の 3.0% だけが乗り換えを起こした染色体を含んでいる。
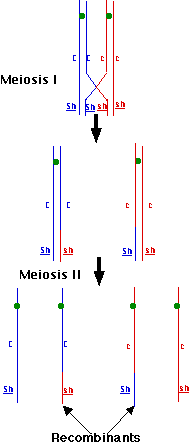
第 1 減数分裂 の前期に,複製された 相同染色体 対が対合し,非姉妹染色分体間で一部の乗り換えが起こる。これによって,”乗り換え配偶子” が出来る。
この場合,乗り換えが穀粒の色の遺伝子座と形状の遺伝子座間で起これば,元々の遺伝子の組み合わせ ( CSh と csh ) が変わってしまい, Csh と cSh を含む新たな組み合わせが生じる。
染色体地図
F1 個体によって形成された乗り換え体の割合は”非常に希な” 1% から”常に起こる” 50% まで変動する ( 独立組み合わせ 参照 )。形質間で乗り換え率が高ければ,2 つの遺伝子座間がそれだけ離れていることを示す。実際には,乗り換えの割合は便宜的に先駆的な遺伝学者 Thomas Hunt Morgan の名にちなんで,センチモルガン (cM) で表わす。上記の例では,遺伝子座 c と sh は 3.0 cM の距離にあるという。
この手法によって,同一染色体上のいろいろな遺伝子座間の比較が出来る。
例
対立遺伝子 C,c とブロンズ色遺伝子 ( Bz,bz ) に対する二因子雑種であるトウモロコシの検定交雑によって,乗り換え個体が 4.6% 生じた。したがって,これらの 2 つの遺伝子座は 4.6 cM の距離にある。さて,遺伝子座 bz は sh と同じ側にあるのか,それとも反対側になるのか?
答えは二因子雑種 Shsh と Bzbz の検定交雑で判明する。
乗り換え率が 4.6% 以下であれば, bz は sh と同様に,c と同じ側にあり,4.6% 以上であればその反対側にあると判定される。
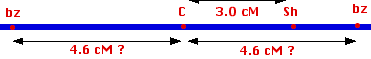
実際,乗り換え率は 1.8% 以下である。このことから,実際の遺伝子座の順番は
c - sh -bz となる。
連鎖分析による遺伝子地図作製は,比較的近接する( 数センチモルガンの範囲 )遺伝子座間でよく利用される。なぜか? 2 つの遺伝子座間の距離が増加すると,それらの間に 2 回目の乗り換えが起こる確率も増加するためである。
しかし,2 回目の乗り換えによって,最初の乗り換えの影響が取り消され,対立遺伝子は元の組み合わせに戻ってしまう。したがって,乗り換えが起こらなかったと判断されてしまう。このように,2 つの遺伝子座が離れれば離れるほど,計算された乗り換え率が実際のセンチモルガン距離を過小評価してしまうことがある。
3 点交雑 three-point cross ( 3遺伝子雑種を戻し交配することにより,3 遺伝子の位置関係とセンチモルガン距離が推定できる)により再乗り換えや遺伝子座間距離を正確に検定できる。たとえば,上記の例の結果を示すと, c - bz の実際の距離は 5 cM となり,
- c-sh = 3 cM
- sh - bz = 2 cM
二因子交雑で求められた 4.6 cM とはならない。
3点交雑により,二因子交雑を繰り替えるよりも容易に遺伝子順序が判明する。
染色体の遺伝子地図を作製する上で別の問題がある。
- 乗り換えの確率は染色体の全長に亘って必ずしも一定ではない。
- 乗り換えはある部分では起こらない(たとえば,動原体付近)
- ある部分では乗り換えが起こりやすい(その理由は分かっていない)。ヒトにおける遺伝的組換えのおよそ80%は,我々のゲノムのちょうど4分の1の領域で起こっている。
- ヒトでは,ほとんどの染色体における遺伝子座の乗り換えの割合が男性よりも女性で高い。したがって,女性の染色体の遺伝子地図が男性のものに比べ長い。
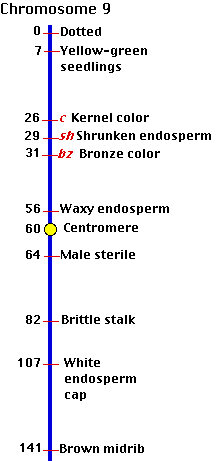
トウモロコシ ( Zea mays ) の第 9 染色体の遺伝子地図を右に示した。 C, Sh, ならびに bz 遺伝子座を確認のこと。
狭い間隔で遺伝子の位置が染色体の一端から他端まで書き込んでいくと,全体のセンチモルガンはしばしば 100 を超えてしまう(右図の 第 9 染色体でも同様)。しかし,かなり離れた遺伝子座でも乗り換えが起こる頻度は最大でも 50% 程度である。そして,これがまた別々の染色体上で独立に組み合わされる遺伝子の乗り換え頻度でもある。したがって,乗り換え体を単純に比較しただけでは,2 つの遺伝子座が同一の染色体にあるのか,別々の染色体にあるのか判断できない。上述したように, Mendel が独立組み合わせの形質として観察したものは同一の染色体上にある遺伝子によって制御されているが,それらの遺伝子座が十分に離れていたために,別々の染色体上に位置していたかのように遺伝したのである。
同一の染色体上に位置する遺伝子を シンテニック遺伝子群 と呼んでいる。
ヒトではどうか?
当然ながら,我々の染色体地図を作成するためにヒトの交配を自由にできない。しかし,親類を含めた数世代において連鎖を調査することにより,染色体上の位置付けを推定することは可能である。
例えば、ユタ州に本拠地をおくモルモン教の大家族から採取された血液サンプルが保存されている( 少なくとも 3 世代の全構成員が採取されている )。遺伝子連鎖の関係を調査するために使用されているが,何年かのうちに他のヒト遺伝子の研究にも利用できるだろう。
遺伝子地図と物理的地図
乗り換え体の数を計算することで染色体上に位置を決め,遺伝子地図が作成される。しかし,染色体上のすべての遺伝子は DNA 1 本鎖に組み込まれている塩基配列であり,これによってコード化されている遺伝子産物によって観察される形質(表現型)が作り出される。【 ATG に始まる DNA 塩基配列で,ストップ・コドンに出合うまで コドン を解読( 翻訳 )していく仕組みを”オープン・リーディング・フレーム(読み取り枠)” open reading frame (ORF) という。】 DNA 塩基配列決定 が急速に進展しているおかげで, 原核生物 やいくつかの 真核生物 の完全な ゲノム が決定されてきている。
塩基配列が決定されれば,遺伝子の位置や間隔が直接決定できる。この方法で作成される地図を 物理的地図 と呼んでいる
染色体上の遺伝子地図と物理的地図との関係は何を意味するのだろうか? 経験に基づく非常にラフなものであるが,染色体上の 1 cM は DNA の 1メガ塩基対 ( 1 Mb = 106 bp ) を含むものと考えられている。しかし既に見てきたように,この関係は概算によるものである。女性の遺伝子地図は男性のものに比べ平均 90% も長いが,染色体に含まれる塩基対の数は同じはずである。したがって,物理的地図 では変わらないはずである
March 27, 2020