アンチセンス RNA
| このページの内容 |
メッセンジャー RNA ( mRNA ) は単一鎖である。その塩基配列が遺伝子産物であるタンパク質を “意味” するので,”センス” と呼ばれる。通常は,対になっていないヌクレオチドが,リボソーム上で 翻訳 過程が進行するのに伴い,転移 RNA ( tRNA )のアンチコドンによって “解読” される。
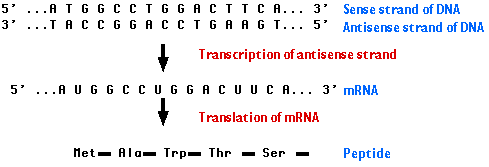
しかし, RNA は DNA と同様に二重鎖を形成する。この時必要なのは最初の一本鎖と相補的な塩基配列を持つ第 2 の RNA 鎖である。たとえば,
5´ C A U G 3´ mRNA
3´ G U A C 5´ アンチセンス RNA
この第 2 の RNA 鎖は,遺伝情報 (センス ) と相補的な塩基配列を持つので, アンチセンス鎖 antisense strand と呼ばれる。
mRNA が相補的なアンチセンス RNA 鎖と二重鎖をつくると,翻訳が阻害される。
その理由は以下の通りである:
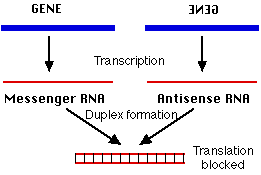
- リボソームが mRNA のヌクレオチドにアクセスできない。または,
- 二本鎖 RNA は細胞内のリボヌクレアーゼ ( RNA 分解酵素 )によって急速に分解されてしまう ( 下記の RNAi 参照 ) 。
組み換え DNA 技術 を用いて,アンチセンス RNA 分子をコードする合成遺伝子 ( DNA ) を生物に導入できる。
例:遺伝子組み換えトマト Flavr Savr tomato
市場へ送られるほとんどのトマトは熟す前に収穫される。そうしなければ,消費者の手に渡る前にトマトで合成されたエチレンによって過熟して,傷んでしまう。
この時に作用する酵素の mRNA に相補的なアンチセンス RNA に 転写 される人工遺伝子 ( DNA ) をゲノムに組み込んだ遺伝子組み換えトマトがつくられた。これらのトマトは,問題の酵素を通常量の 10% しか作らない。
当初の目的は,熟したままのトマトの外観および味に近いものを市場に供給することだったが,このトマトは輸送や取り扱いの間に傷んでしまい,普及はしなかった。
他の例:

右:通常の花着色のために必要な mRNA のアンチセンス RNA で組換えたタバコ (植物 )の花。
左: 別の遺伝子組み換え植物の花。この場合,色素沈着は変化しなかった
( van der Krolら, Nature,333:866, 1988 )。
トランスジェニック植物(遺伝子導入植物)の作出
植物に遺伝子を導入する方法がいくつかある ( 右図 ) :
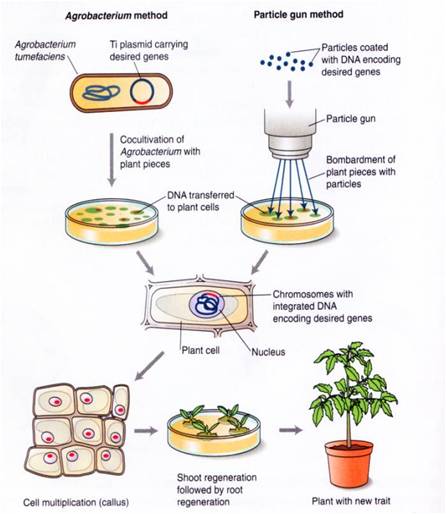
動物と異なり,体細胞と生殖系列 の細胞に実質的な違いがない。植物の体細胞,たとえば培養で増殖させた根の細胞に対して,
- 希望する遺伝子をきっけんてきに導入して,
- 花を咲かせた成熟植物に生長させることができる。
すべてがうまくいけば,導入遺伝子は花粉等に取り込まれ,次世代に受け継がれる。
この点で,遺伝子導入動物 より遺伝子導入植物をつくる方が容易だろう。
アンチセンスRNAは天然にも存在する
本来の仕組みで翻訳された遺伝子が,細胞の他の遺伝子の翻訳を阻止するアンチセンス RNA 分子になることがあるか?
答えは「イエス」である。そして,遺伝子発現を制御する方法の 1 つとも考えられる。
マウスおよびヒトの両方で,父親から受け継いだインシュリン様成長因子 2 受容体 ( insulin-like growth factor 2 receptor, Igf2r ) の遺伝子が,Igf2r の mRNA 合成を阻止するアンチセンス RNA を合成する。遺伝子の発現が,母親あるいは父親から継承されたかどうかに依存して異なる場合があり,これを ゲノム・インプリンティング (ゲノム刷り込み,genomic imprinting )と呼ぶ。
RNA 干渉( RNAi )
アンチセンス RNA の影響を調べる際に,対照区として同じコード領域のセンス RNA を使用するはずである。驚いたことに,調製したセンス RNA がアンチセンス RNA と同程度の抑止効果を持つことが判明した。
なぜか? センスRNAを実験的に調製すると,センス鎖とアンチセンス鎖の混成物が含まれているようである。したがって,これらが二本鎖RNA(double-stranded RNA , dsRNA)の二重らせんを造ってしまう。
二重鎖 RNA はその遺伝子の強力な抑制遺伝子のように働く。事実,アンチセンス RNA の抑制効果がその二重鎖 RNA を形成する能力に依存している ( 相当する mRNA をテンプレートとして用いる)。
二重鎖 RNA が,自身の配列に相当する遺伝子の発現を抑制することを RNA 干渉 RNA interference ( RNAi )と呼ぶ。これはまた 転写後の遺伝子抑制 ( post-transcriptional gene silencing,PTGS ) とも呼ばれる。
RNA 干渉の機序
細胞質で認められる通常の RNA 分子は 一本鎖 mRNA 分子である。細胞が二本鎖 RNA (dsRNA)と遭遇すると,Dicer とう酵素を動員して 約21 塩基対の断片に分解してしまう (これは二重らせんの約 2 旋回程度の長さである)。
その後,各断片の 2 本の RNA 鎖は解離し,アンチセンス鎖 も遊離してしまう。これが mRNA 分子の 相補的センス鎖 と結合してしまうため,その mRNA のペプチド翻訳機能が機能しないようにしてしまう。
このように作用するために,RNA の断片は “短い干渉 RNA” ( short ( or small ) interfering RNA,siRNA ) と名付けられている。
siRNAとタンパク質の複合体は,RNA 誘導サイレン シング複合体(RNA-induced silencing complex,RISC)と呼ばれている。
siRNA は転写も抑制する
siRNAが遺伝子の転写を抑制する可能性を示す証拠が集まりつつある。
- DNA上の補完的な配列と結合することによって,あるいは
- RNAが形成される過程で,新生RNA転写物におそらく結合することによって
分裂酵母では,少なくとも、siRNAは3つの異なるタンパク質のうちの1分子と複合体を形成する。この複合体はRITS(“RNA-induced initiation of transcriptional gene silencing”)複合体と呼ばれる。
転写遺伝子サイレンシングRNA干渉誘導開始複合体
これらのsiRNAが,どのように核のDNAにアクセスし,細胞質で合成されるのかは不明のままである。
遺伝子プロモーターに結合するsiRNAの人工合成物でも,当該遺伝子の転写を抑止してしまう。この抑止は,プロモーター中のDNAのメチル化と,おそらくその周辺のヒストンのメチル化に依るものだろう。
異常に低い濃度のグルテリンと呼ばれるタンパク質を産生するコメの系統(LGC-1)がある。コメにはいくつかのグルテン遺伝子があり,そのうちの
- 2つの極めて類似したグルテリン遺伝子が同じ染色体上に連続している
- LGC-1では,2つの遺伝子間で欠損が起こり,最初の遺伝子の後の転写を停止させるシグナルが無くなっている
- そのため,RNAポリメラーゼIIは最初の遺伝子の転写を終了することなく,2番目の遺伝子を転写することになる
- その結果,ほとんど同じ配列が反対方向に向いたmRNAが形成される
- その結果,これらのmRNAは二重鎖RNA(dsRNA)分子に組み込まれてしまう
- Dicerのような酵素がdsRNAを低分子二本鎖RNAに切断して,他のグルテン遺伝子と同様にこれらの遺伝子のその後の転写を抑止してしまう
RNAi の役割は?
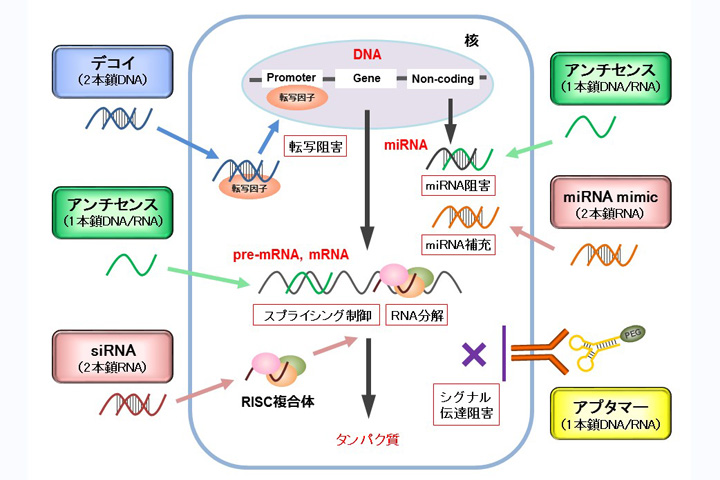
RNAi は植物,菌類,ならびにショウジョウバエや線虫,さらにはマウスやゼブラフィッシュのような動物において動作することが知られている。このようにいろいろな種の細胞が反応するということは,何らかの重要な機能を持っているはずである。その機能は何であろうか?
いくつかの可能性
- 動植物のある種のウイルスは 二重鎖 RNA のゲノム を持つ。そして他のウイルスの多くは単一鎖 RNA ゲノムを持つが,宿主細胞内で簡単に二本鎖 RNA に変化する。
したがって,RNA 干渉 ( RNAi )は,これらのウイルスによる感染に対抗するための防御方法と考えられる。すなわち,ウイルスの mRNA の機能を破壊しウイルスに必須のタンパク質を合成させないようにしていると思われる。 - トランスポゾンがRNAに転写されても, 二本鎖 RNA となる領域があれば,RNA干渉によって転移が抑制される。
- RNA 干渉は遺伝子発現を制御する別の基本的な過程である可能性がある〔以下を参照のこと〕。
ツールとしての RNA 干渉
いかなる場合でも,RNA干渉の発見により分子生物学者の道具箱に有望なツールが加わった。特定の遺伝子と符合している二重鎖RNAを導入することにより,その細胞での当該遺伝子の発現をノックアウトすることになる。 たとえば,線虫 に二本鎖 RNA をつくる 大腸菌 を与えるとそのノックアウトが可能となる。
注目すべき研究報告
Natureの2005年3月24日号で,Sönnichsen らが以下の内容を報告している。彼らは線虫の遺伝子の20,326個(全体の98%にも及ぶ!)と対応している dsRNAs を注射して,減数分裂(受精後)から4細胞期胚となる体細胞分裂の2サイクル目が完了するまでの初期胚発生の各段階への影響を追跡した。
その結果,少なくとも661個の遺伝子の内,
- およそ半分が細胞分裂の関連している。
- 他の半分が細胞の代謝に関連している。
ことを明らかにした。他の数千の遺伝子は,その後の発生段階で認められる表現型の発現に関与していた。
選ばれた時間に特定の組織で RNAi が実施できるので,従来の遺伝子「ノックアウト」に勝る利点がある。遺伝子ノックアウト法だと,欠損した遺伝子が生殖細胞系列に取り込まれても,その遺伝子の欠損のために胚を研究する前に死滅してしまう欠点がある。
もう一つの例:遺伝子の薬剤感受性に対する影響のスクリーニング
- 何千にも及ぶウェルにあなたの細胞を分配して, 全ゲノムを代表する何千もの siRNAs の「ライブラリ」から 1つの遺伝子の発現に対応した siRNA 分子を,各々のウェルに 加える。
- すべてのウェルに対象薬剤を添加する。
- 反応した細胞が入っているウェルがどれかを調べる。
RNA 干渉の有望な他の応用例
哺乳動物細胞
哺乳動物の細胞で,dsRNA 断片を導入することにより,一時的に遺伝子発現が低下できる。しかし,抑制したい遺伝子に対応した配列を含む 「小ヘアピンRNA」(small hairpin RNA,shRNA) と呼ばれる50~80ヌクレオチドのRNA分子をコードするDNAベクターを哺乳動物の細胞に感染させる。
shRNA のヘアピン構造は細胞機構(ダイサー)によって siRNA へと切断され,RNA誘導サイレンシング複合体(RISC)と結合する。この複合体は siRNA と相補的な配列を持つ mRNA に結合し,切断する。
細胞が shRNA を連続的に合成することができるので,RNA干渉は長期にわたる。実際,宿主ゲノムに取り込まれたベクターをもつので,RNAi は子孫にも受け継がれる。
植物
Natureの2003年6月19日号で,カフェインを作るために必要な遺伝子の発現をRNA干渉で抑制できるように設計したsiRNAを合成するように遺伝子工学的に作製した導入遺伝子をもつコーヒーノキに関する報告が掲載されている。
コーヒー豆から化学的にカフェインを除去しなくても,カフェイン抜きのコーヒーが飲める日がいつか来るだろう。
ウェスタン・コーン・ルートワーム(アメリカやヨーロッパの一部でトウモロコシに甚大な被害をもたらしているコウチュウ目の重大な害虫のこと)の必須遺伝子配列に対応した dsRNA を発現する遺伝子改変トウモロコシが,モンサントで造られ市場出荷の承認が得られている。
この dsRNA を摂取した後に,昆虫自身の細胞は遺伝子の mRNA を標的として2-3日中に昆虫を死滅させる siRNA に変化する。
RNA 干渉増幅
線虫,植物ならびにアカパンカビにおいて,2~3個のdsRNAの分子を導入すると,長期にわたる効果が持続する。植物では,細胞間連絡を介して隣接細胞へ,師部を介して植物体の他の部位に遺伝子サイレンシングが伝搬する。細胞内でのRNA干渉はその後継細胞における体細胞分裂の後に継続する。線虫でRNA干渉を誘発すると,生殖細胞系列を介して子孫に受け継がれる。
最初の誘発シグナルがどんどん増幅するのは触媒作用に依るものと示唆される。これらの生物は,より多くの siRNA を合成する鋳型として,最初のアンチセンス siRNA によって標的にされた mRNA を利用するRNA依存性RNAポリメラーゼ(RdRPs)をもつことが分かっている。
これらの「第二の」siRNAs の合成は,mRNAの隣接した領域でも起こる。
それで,これらの第二の siRNAs は最初の mRNA のさらなる領域を対象とすることができるだけでなく,ヌクレオチドの同じ配列をもつかもしれない他の遺伝子のmRNAを場合によっては抑制できるかもしれない。
この現象は,二次的RNA干渉(transitive RNAi)と呼ばれ,この現象のために,
- 標的遺伝子に加え,他の遺伝子の発現も抑制してしまうので,遺伝子抑制実験の解釈を難しくしているようだ。
- (RdRPsや増幅が哺乳動物では観察されていないとはいえ,)治療のために単一遺伝子を抑制する目的で,RNA干渉を利用するのには注意が必要である。
治療に用いられる RNA 干渉

(トランスサイレチン型家族性アミロイドーシス)
RNAi(RNA interference=干渉)治療薬「patisiran(パティシラン)米国名:ONPATTRO」
標的遺伝子がとても特殊なので,その遺伝子の発現をRNA干渉によって抑止できるとすると,新しい種類の治療薬の開発の兆しが見えてきそうである。最近(2018年8月10日),米国FDAは最初のsiRNA薬品を認可した。
遺伝疾患である”遺伝性トランスサイレチン型アミロイドーシス”の治療にパティシラン Patisiran (米国名:Onpattro®) が使われている。
トランスサイレチンは肝臓で合成された血清タンパク質の一つで,甲状腺ホルモンであるサイロキシン(T4)やレチノール(ビタミンA)の輸送担体として働く。
トランスサイレチンと呼ばれるタンパク質が遺伝的に変異を起こすと,アミロイドと呼ばれる物質が全身に沈着する(溜まる)。 アミロイドーシス を発症すると,しびれや感覚障害,吐き気や下痢,視力の低下など全身にさまざまな症状が現れる。
パティシラン siRNA はトランスサイレチンのメッセンジャーRNAを標的とし、変異トランスサイレチンの翻訳と合成を抑止してノックダウンする。パティシランを投与された患者は症状や兆候の著しい改善を示すが,ビタミンAの補給が必要である。
パティシランは世界初となる「siRNA」治療薬である。
多種多様な病気の治療においてsiRNA分子を使用した多くの臨床試験が行われている。
1つの例:
PCSK9と称されるタンパク質が翻訳されるメッセンジャーRNAに結合するsiRNAは、血中の低密度リポタンパク質(LDL、「悪玉」コレステロール)の濃度を減らす。PCSK9は,LDLとそのレセプター(LDLR)の複合体に結合するセリン・プロテアーゼであり,細胞内の受容体の分解を促進する。より多くのLDLを除去できる細胞表面の受容体が少ないと,血中のLDLレベルが上昇する。
細胞内のPCSK9の合成を減らすことによって,siRNAは血中の「悪玉」コレステロールの濃度を低下させ,結果的に心臓発作や他の心血管問題の危険性を減らしてくれる。
マイクロ RNA
線虫では,その幼虫期から成体に至るまで少なくとも2個の「マイクロRNA」(「miRNA」)が必要である。すなわち,約22個のヌクレオチドを含む一本鎖 RNA 分子で,siRNA とほぼ同じ大きさの RNA 分子である。
線虫の Dicer が大型の前駆体を認識し切断して,これらの小型の単一鎖転写産物が生成する。
線虫におけるいくつかのメッセンジャーRNAを破壊したり,(通常,mRNA の 3′-非翻訳領域[3′-UTR]の補完的な配列領域へ結合して)翻訳を阻害するように「マイクロRNA」は作動する。
線虫におけるマイクロRNA(miRNA)〔当初は「小分子RNA」small temporal RNA, stRNA と呼ばれていた〕は,生物自身の遺伝子によってコードされている RNA の大きな集団の一つであることが分かってきた。
- 最初の遺伝子転写産物は,pri-miRNA(primary miRNA,初期転写産物)と呼ばれている大きな分子である。
- 核内に存在する RNaseIII 様の Drosha (ドローシャ) と呼ばれる酵素がこの pri-miRNA 分子の一部を切断して、約70塩基長のステムループ構造をもつ pre-miRNA (precursor miRNA,成熟した miRNA の前駆体)を作る。
- 次いで,pre-miRNA 分子は Exportin-5 と呼ばれるキャリアタンパク質によって細胞核の外に輸送され,細胞質で切断され(動物では Dicer によって),miRNA となる。
マイクロRNA は,
- すべての動物と植物で見つかっている(ヒトでは500種類以上の miRNA を生成している)。
- 19-25個のヌクレオチドを含む。
- ゲノムにコードされている。
- あるものは構造遺伝子によってコードされ,
- あるものはイントロン領域によって,その遺伝子のmRNAを調整する
- 発現するのは,
- 特定の細胞においてのみ
- 特定の細胞の分化の特定の時期においてのみ
これらの新たに発見された多くの遺伝子産物の機能に関する詳細は分かっていないが,それらは以下の方法で mRNA を調整することによって遺伝子発現を制御している。
- 完全に相補的な配列をもった mRNA を破壊する(植物では一般的である)
- 部分的に一致した配列をもっている場合にはその翻訳を抑止する
後者の場合では,3’-非翻訳領域にいくつかの miRNA が同時に結合する必要がある。
[ 遺伝子の翻訳についてはこちら ]
これらの “マイクロRNA は,上記の作用を果たすために 2 つの特質を持つ:
マイクロRNAは,同様に哺乳動物で遺伝子の発現(抑制)を調整する。我々の 一つ以上の miRNA が結合する可能性を持つ配列を含む転写産物(mRNA)を形成する何千ものヒト遺伝子がゲノム解析によって明らかになっている。
各々の mRNA が複数の miRNA との結合部位をもつが,おそらく各々の miRNA は200種類もの異なる mRNA 標的分子と結合することができる。そのようなシステムによって,mRNA の翻訳がいろいろ調節される多くの機会が生じる。
Natureの2005年2月17日号(Limら, 433:769-773)では,DNAチップ解析を使った研究が報告されている。〔Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs〕
特定の miRNA が HeLa 細胞で表現された場合,
- 通常,脳で発現される miRNA が,174個の異なる遺伝子による mRNA 産生を抑制した
- 通常,心臓と骨格の筋肉で発現される miRNA は,96個の遺伝子による mRNA 産生を抑制した。それらの8個を除いたすべてが,脳の miRNA によって抑制されたものとは異なっていた。
この領域での研究が進むにつれ,明らかになってきたことをまとめると,
- 多くの遺伝子(とくにすべての細胞に共通のハウスキーピング活動(例えば、細胞呼吸)に関係する遺伝子)は,ゲノムにコードされているどの miRNA でも阻害される3′-非翻訳領域を持っていない。
- 特定の種類の分化細胞およびまたはその細胞の生活環の特定の時間に発現されなければならない遺伝子は,
- その遺伝子の発現を阻害できる miRNA 遺伝子の何も発現しないが,
- その時点でその細胞に適切でない特殊な機能のための他の遺伝子の発現を阻害する miRNA 遺伝子を発現する。
- 遺伝子発現をオンまたはオフにする単純なスイッチであるよりはむしろ,miRNAsはより繊細な影響,すなわち(転写因子がするような)遺伝子発現のレベルを上げ下げする様な影響を及ぼすようである。
このように,miRNA による遺伝子発現の抑制によって,細胞が特定の経路に沿って分化していくように,遺伝子発現を確実に制御・調整する役割を果たしているように見える。
たとえば,ゼブラフィッシュの胞胚で接合体の遺伝子がスイッチオンされ始めた場合,それらの1つは miRNA をコードしていて,それまで着々と進行していた母親の多くの mRNA を分解し始める。
このように miRNA は,特定の時間に特定の種類の細胞の複数の遺伝子の発現を制御・調整して転写因子と同じくらい重要な役割を演じているようだ。
治療に miRNA が利用できるか?
比較的楽に,miRNA を細胞に導入して遺伝子発現をいろいろ制御できぬので,遺伝的な疾患(例えば,ガン)をおさえる際に有効かもしれないという望みを抱かせてくれる。
これまでのいくつかの研究は極めて有望である。
- G1期とS期のサイクリンの発現を阻害して細胞周期を停止させる miRNA は、マウスを肝がんから守る。
- 転移に必要な遺伝子を阻害するmiRNAは,治療をうけている人の乳ガン細胞の転移を抑える。
まとめ
転写因子に加えて,真核生物は遺伝子発現を調整するために小さなRNA分子を用いており,ほとんどいつも阻害的に作用するのでその現象はRNAサイレンシングと呼ばれている。
小分子RNAには2種類ある。
- “短い干渉 RNA” small interfering RNAs (siRNAs)
- 植物細胞は感染したウイルスの二重鎖 RNA から siRNA を作製する。
- 科学者や製薬会社では特定の遺伝子を発現させない手法として利用している(RNA干渉,RNAi と呼ばれる)。
- “マイクロ RNA” micro RNAs (miRNAs)
- すべての動植物のゲノムにコードされている。
- RNAsとmiRNAsの両者は細胞質で同様に処理される。
- 両方とも Dicer によって切断され生じる。
- 両方ともRNA誘発サイレンシング複合体(RISC)に取り込まれる。
実験用ツール,ならびに治療用ツールとしての使用以外に,小分子 RNA は生物にとって明らかに必要である。
いくつかの例:
- 植物と動物はウイルスに対して自身を守るために,それらを利用している。
- たとえば,ヒト細胞がC型肝炎ウイルス(HCV)に感染した場合に,このRNAウイルスによる遺伝子発現とその複製能を妨害する miRNA を産生する。
- 一部のヘルペスウイルスは,ウイルス複製を完了するのに都合が良いように宿主細胞が十分長く生きるように仕向けている(感染した宿主細胞に対して免疫反応を鈍くし,かつアポトーシスによってその早死を防止することによって)。
- ショウジョウバエ胚で発現される46種類のmiRNAsのうち,25種類は正常な発達にとって必須であることが示されている。
- 他の動物(例えば,線虫,ゼブラフィッシュ,マウス)の適切な初期胚発生にも必要である。
- ゲノム内を動き回っているトランスポゾンによって引き起こされる突然変異の危険から保護するのに必要である。
- 少なくともある種類の幹細胞の集団の大きさを調整するためにも必要である。
- 一本鎖 miRNA で特定の遺伝子をノックアウトされたマウスは,樹枝細胞,ヘルパーT細胞ならびにB細胞に影響を及ぼす重篤な免疫不全になる。
- ヒトのいくつかのガンでは,特定の miRNA の発現が低下したり,全く発現しなかったりすることがあある。
March 31, 2020