バイオテクノロジーと Genomics
| このページの内容 |
組み換え DNA 技術によるヒト遺伝子地図の作成
遺伝子地図を作製することが,ヒト遺伝学の 1 つの基本的課題である。これにはいくつかの方法があり,古典的な方法としては,”遺伝子の連鎖性” を用いた方法がある。
しかし,この方法では位置が決定できる遺伝子数に限界がある。
| こちらのリンクを参照のこと |
|---|
| 組み換え頻度から遺伝子地図をつくる |
| 染色体地図 |
現在,組み換え DNA 技術を利用したいくつかの新しい方法によって,遺伝子地図作成 が可能となっている。ここでは,以下の代表的な方法を紹介する。
- RFLP による方法 – 制限酵素断片長多型 restriction fragment length polymorphism
- FISH による方法 – 蛍光インサイテュー・ハイブリダイゼーション法 Fluorescent?in situ?hybridization
- 塩基配列決定
RFLP の発見と遺伝子マーカーとしての利用
組み換え DNA 技術を用いた遺伝子地図作りの 1 つの方法は,制限酵素 restriction enzyme による切断部位の変異を見つけることから始まった。
我々の?ゲノム?の塩基配列,とくに遺伝子領域間や遺伝子内のイントロン領域にある塩基配列にはいろいろな変異が認められる。この変異があるために,制限酵素による切断部位に差が生じる。
これらの変異は?共優性形質?として遺伝し,特定の染色体の特定の領域に認められるので,遺伝子マーカー?として利用できる。言い換えると,
| すべてのヒト染色体上の変異部位の遺伝子地図を作成して,これを染色体上のマーカーとして活用し,遺伝病の原因遺伝子との連鎖を調べることによって,その問題遺伝子の位置を同定することができる。 |
これらの変異を,制限酵素断片長多型 restriction fragment length polymorphism ( RFLP ) という。
RFLP は白化症のような目に見える表現型を示さないし,血液型のような反応として見ることがでず,DNA 断片の数や大きさの違いとして同定することができる。
RFLP の分析のために,
- 少量 ( 10 – 20 ml ) の血液を採り,白血球を分離して DNA を抽出する。
- 制限酵素 ( 二本鎖 DNA の特定の塩基配列を認識し,切断する酵素 ) を用いて ゲノムDNA を多数の DNA 断片に切断する。
- 切断した DNA 断片をアガロース電気泳動にかけると,長さの異なる断片がそれらの移動度の差から分離してくる。
- サザンブロット?Southern blot と呼ばれる方法でゲル中の特定の DNA 断片を検出する。
このように特定の制限酵素による DNA 断片の長さの差が移動度の違いとして検出される DNA の多型を 制限酵素断片長多型 restriction fragment length polymorphism ( RFLP ) という。
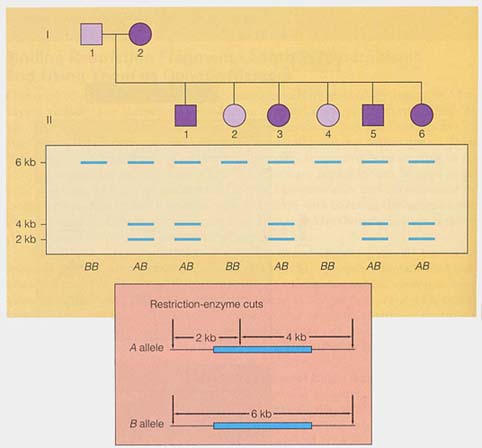
| 制限酵素断片長多型の例 |
| 制限酵素断片長多型?の詳細についてはこちら |
RFLP を用いた遺伝子地図作成
- まず,家系図を作り,遺伝病がどのように遺伝しているのかを分析する( 右図 )。
- ついで,家族構成員の DNA を検査し,それぞれの染色体に特異的な RFLP マーカーの遺伝様式を確認する。
もし,問題の遺伝病とある染色体に特異的な RFLP マーカーとが数世代共に遺伝していれば,両者は同一の染色体上のお互いに近い部位に位置することになる。
このように RFLP 分析を取り入れて遺伝子地図を作成する方法は ポジショナル・クローニング positional cloning と呼ばれている。すでにこの方法で,100 を超える遺伝病遺伝子の染色体上の位置が決定されている。それらのいくつかを表 1 に示す。
| 表 1. ポジショナル・クローニングによって同定された遺伝子の例 | |||
|---|---|---|---|
| 遺伝子 | MIM/OMIM# | 遺伝子 | MIM/OMIM# |
| 第 4 染色体 | 第 17 染色体 | ||
| ハンチントン舞踏病 Huntington disease |
143100 | 乳癌 Breast cancer ( BRCA1 ) |
113705 |
| 第 5 染色体 | 神経線維腫症 Neurofibromatosis ( NF1 ) |
162200 | |
| 家族性ポリープ症 Familial polyposis |
175100 | 第 19 染色体 | |
| 第 7 染色体 | 緊張性ジストロフィー症 Myotonic dystrophy |
160900 | |
| 嚢胞性線維症 Cystic fibrosis CF |
219700 | 第 21 染色体 | |
| 第 11 染色体 | 筋萎縮側方硬化症 Amyotrophic lateral sclerosis |
105400 | |
| ウィルムス癌 Wilms tumor |
194070 | X 染色体 | |
| 運動失調-毛細血管拡張症 Ataxia-telangiectasia |
208900 | デュシェンヌ型筋ジストロフィー Duchenne muscular dystrophy ( DMD ) |
310200 |
| 第 13 染色体 | 脆弱 X 染色体症 Fragile-X syndrome |
309550 | |
| 網膜芽細胞腫 Retinoblastoma |
180200 | 副腎白質ジストロフィー Adrenoleukodystrophy ( ALD ) |
300100 |
| 第 16 染色体 | |||
| 多発性嚢胞腎 Polycystic kidney disease ( PKD ) |
173900 | ||
染色体上の遺伝子の位置を決める
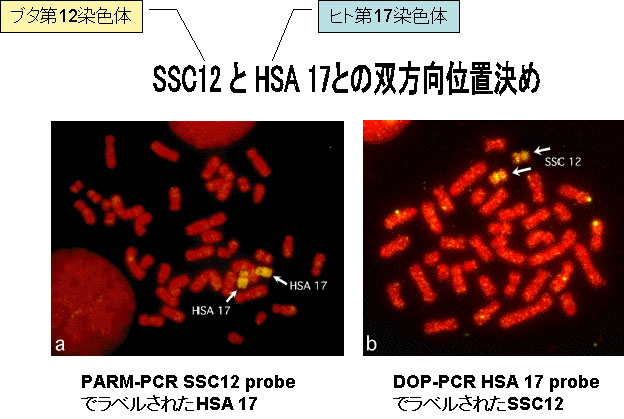 クローンされた遺伝子に標識をつけ,それをプローブとして用いて染色体上の遺伝子の位置を決める方法がある。
クローンされた遺伝子に標識をつけ,それをプローブとして用いて染色体上の遺伝子の位置を決める方法がある。
Fluorescent?in?situ?hybridization?FISH?法では,蛍光色素で標識されたプローブを,巻き戻し処理をした分裂中期の染色体と反応させる。プローブは染色体上の相補的な DNA 配列と結合する ( ハイブリッドを形成するという ) 。
ハイブリッドを形成したプローブは顕微鏡で観察できる。相同染色体上に一対の明るい蛍光スポットとして観察され,遺伝子の位置が示される( 右図 )。
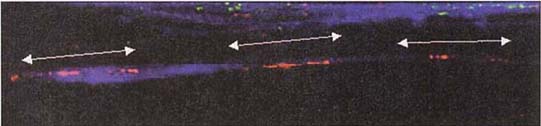
さらに,高解像度で位置決めをする場合は,染色体を DNA – タンパク質線維にまで巻き戻してハイブリッド形成させることによって, 2 個以上の遺伝子の配列順序と距離を知ることができる( 下図 )。
DNA フィンガープリント法
RFLP 分析は
- 遺伝子地図作成以外にも
- 法医学
- 生態学
- 考古学
- 絶滅種の保護
- 動物の育種
などの分野にも利用されている。
ヒトゲノムにみられる別の塩基配列の変異が遺伝子マーカーとして利用できる。
1980 年代に,Leicester 大学の Alec Jeffreys らが,ミニサテライトと呼ばれる DNA 配列の反復数が異なる変異が特定の染色体に存在することを見出した。
最近になって,一塩基変異多型?single?nucleotide?polymorphism ( SNP ) とよばれる別の塩基配列の変異も発見されている。
- RFLP
- ミニサテライト
- SNP
など,いろいろな塩基配列の変異が,犯罪捜査,人類進化,人種形成の研究などのいろんな分野で利用されている。
ここでは,DNA フィンガープリント法について紹介する。
ミニサテライトと直列の反復配列
DNA フィンガープリント法はミニサテライトの長さの変化を検出する。ミニサテライトは 14 – 100 塩基からなり,反復してみられる。
たとえば,
CCTTCCCTTCCCTTCCCTTCCCTTCCCTTC
は, 5 塩基 CCTTC を単位とする配列が 6 回繰り返した直列の反復配列である。
このような反復配列がすべての染色体に散在している。
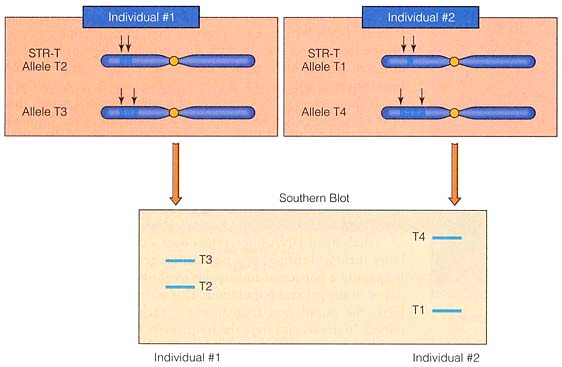
これらの ミニサテライト は short tandem repeat ( STR ) と呼ばれ,反復数は 10 – 1,000 回にものぼり,その数が場所により異なるので,制限酵素で切断した後共通配列のミニサテライトをプローブとしてサザンブロットを行えば数多くのバンドからなる複雑な泳動パターンが得られる( 右上図 )。
この泳動パターンが DNA フィンガープリントである。従来の指紋と同じように,人は常に同じパターンを示す。異なる複数の STR を分析すれば,多くの変異があるので,各個人の特異的なパターンが見られる ( ただし,一卵性双子を除いて ) ( 右下図 )。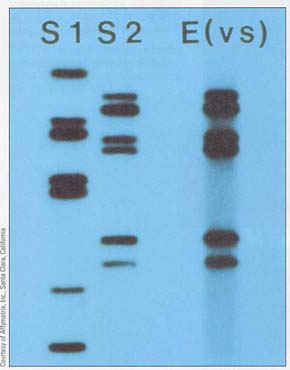
DNA フィンガープリントの応用例
- 法医学 – 犯罪解明への利用
- 実父確定
- イヌなどの血統の確認
- 絶滅種と近代種との血縁関係
畜産の領域では,従来鼻紋,斑紋,血液型などにより行われてきた
などに利用される。 |
STR 対立遺伝子の組み合わせによって,どの程度の信頼度をもつ結果が得られるかを表 2 にまとめた。
| 表 2. DNA フィンガープリント法による結果の信頼性 | ||
|---|---|---|
| 遺伝子座 | 集団内での確率 | 全体の確率 |
| 1 | 1/25 ( 0.040 ) | – |
| 2 | 1/100 ( 0.010 ) | 1/2500 |
| 3 | 1/320 ( 0.0031 ) | 1/806,000 |
| 4 | 1/75 ( 0.0133 ) | 1/60,600,000 |
したがって,遺伝子座 1 – 4 までを組み合わせて分析した場合の STR 対立遺伝子の特定の組み合わせをもつ人は 6 千万人の集団に 1 人だけであることを意味する。
ヒトゲノム・プロジェクト
組み換え DNA 技術の確立とその利用によって遺伝子地図が作成できるので,ヒトのゲノムに含まれるすべての遺伝子について検討することが可能となってきた。数年の議論を経て,ヒトゲノム・プロジェクトは 1991 年に米国で始まった。
このプロジェクトの目的は,ヒトゲノムに含まれるすべての遺伝子の染色体上の位置を決め,それらの遺伝子の塩基配列を決定することである。その後,国際的なプロジェクトに発展していった。現在まで,数百種の生物で塩基配列の解読が終了,または進行中である。
| このプロジェクトに含まれる代表的な生物の?ゲノムサイズ?はこちら |
| またこのプロジェクトの?これまでの経過?についてはこちら |
| ヒトゲノム・プロジェクト?についてはこちらも参照のこと |
ゲノムプロジェクトによって新たな学問領域が作り出された
ヒトや他の生物のゲノムの複製や配列決定に用いられた方法等を含めて,ゲノムの構造や機能を解析する分野を?ゲノミクス?genomics と呼ぶ。塩基配列が決定されれば,データベースに蓄積され,遺伝子の同定や機能の分析に用いられる。
これに関わる新しい分野として?バイオインフォマティクス?bioinformatics〈生物情報科学 – 生物学,とくに DNA の研究を迅速化・効率化するためのコンピュータ・データベースの構築や,アルゴリズムの研究開発など〉が確立されている。ゲノムデータベースを利用することは,今では遺伝学者や他の生物学者の必須のツールとなっている。
| 遺伝子のクローニングの方法を示す模式図 |
| プロテオミクス?についてはこちら |
ヒトゲノムについて分かってきたこと
ヒトゲノムは膨大で,DNA の塩基配列は 30 億を超えるが,遺伝的情報がコード化されているのはこのうちの約 5% に過ぎない。
残りの部分は特定の遺伝子がコードされていない,スペーサー DNA である。遺伝情報はすべての染色体上に分布するが,その間隙は遺伝子を含まない広い領域が埋めている。遺伝子を含まない領域は染色体染色のバンド部分に相当する。ヒトの遺伝子のすべてが同定されていないが,ヒトは 32,000 の遺伝子をもつようだ。これは予測されていた数 ( 80,000-100,000 ) よりかなり少ない。[遺伝子の種類参考図]
ゲノム・プロジェクトが開始された初期の段階から,突然変異や遺伝子機能などの遺伝現象について新しい情報がもたらされている。
たとえば,
- 3 ヌクレオチド反復数増大によって生じる突然変異の発見などである。
この機構は,神経系の異常として極めて重要で,その理由を探求することによって,これらの遺伝病に対する処置法について示唆を与えるだろう。 - 予想もしていなかった知見としては,単一遺伝子の突然変異が,遺伝子の影響の受け方によって異なる遺伝病の原因になるということである。
たとえば,RET 遺伝子 ( MIM/OMIM 164761 ) は細胞膜を行き来するシグナルの輸送に関わる受容体タンパク質をコードしている。この遺伝子内の突然変異のタイプと部位によって, 4 種類の遺伝病になることが分かってきた。すなわち,- 2 種類の多発性内分泌腺腫 multiple endocrine neoplasia ( MIM/OMIM 171400 と MIM/OMIM 162300 ) ,
- 家族性甲状腺ガン familial medullary thyroid carcinoma ( MIM/OMIM 155240 ) ならびに
- ヒルシュスプラング病 Hirschsprung disease ( MIM/OMIM 142623 )である。
- また,重要な発見としては,DNA の修復に影響するいくつかの突然変異がゲノムのある領域を不安定化させることである。
そのため,さらなる突然変異を生ずることが多く,しばしばガン化してしまう。
以上述べた知見や関連の情報は,いろいろな遺伝病に対する診断,処置,ならびに遺伝相談などに関してすでに影響を及ぼし始めている。
遺伝子導入技術の応用
 組み換え DNA 技術は,特定の遺伝子のコピーを大量に得るために,大腸菌に外来遺伝子を導入していた。
組み換え DNA 技術は,特定の遺伝子のコピーを大量に得るために,大腸菌に外来遺伝子を導入していた。
後になって,宿主大腸菌に真核生物のタンパク質を製造させる技術に発展していった。遺伝子導入は宿主細胞として大腸菌を用いるだけとは限らない。
高等生物間での遺伝子導入も可能である( 右図 )。ここでは,遺伝子導入技術が現在どのように利用されているかについて述べる。
生物薬剤製造 Biopharming: 動植物で医薬品をつくる
組み換え DNA 技術の最初の実用例の 1 つが,ヒトの疾病に処置すべく利用されるタンパク質の製造であった。
ヒトインシュリン遺伝子を大腸菌へ導入して製造されたヒトインシュリン製剤が 1992 年に初めて市場に流通し,糖尿病の治療に広く用いられている。それまでは,動物や血液サンプル,さらには亡くなった人からもこの物質が回収されていた。
場合によっては,このようなタンパク質の供給源が重大で,致命的な危機をもたらす可能性に発展することがある。
たとえば,X 連鎖劣性遺伝病である血友病は血液凝固因子を生産できず,出血が止まらない。以前は,献血された血液から血液凝固因子を抽出して用いられた。しかし,AIDS の発症に関係する human immunodeficiency virus ( HIV ) の検査をせずに血液製剤が利用されていたので,こららの製剤で処置された 90% に及ぶ患者が HIV に感染した。
組み換え DNA 技術は,血液凝固因子,インシュリンなど,治療に用いる多くのタンパク質を製造するのに利用されている( 表 3 )。
| 表 3. 組み換えDNA 技術によって作製された製剤の例 | |
|---|---|
| 製剤 | 用途 |
| 心房性ナトリウム利尿因子 | 高血圧,心疾患の治療 |
| ウシ成長ホルモン | 乳牛の乳生産向上 |
| セルラーゼ | 家畜飼料のセルロース分解 |
| コロニー刺激活性因子 | 白血病の治療 |
| 上皮細胞増殖因子 | 火傷の治療,皮膚移植後の生着率向上 |
| 赤血球生成促進因子 | 貧血の治療 |
| B 型肝炎ワクチン | B 型肝炎ウイルスの感染予防 |
| ヒトインシュリン | 糖尿病の治療 |
| ヒト成長ホルモン | 小人症や他の成長不全の治療 |
| インターフェロン ( α,γ ) | ガン,ウイルス感染の治療 |
| インターロイキン-2 | ガンの治療 |
| スーパーオキシド・ジスムターゼ | 組織移植の生着率向上 |
| 組織プラスミノゲン活性化因子 | 心臓発作の治療 |
組み換え DNA 技術によって作られるタンパク質は治療薬だけとは限らない。他の応用例もある。
当初,組み換えタンパク質は大腸菌宿主で製造されていた。大腸菌はヒトのタンパク質を遺伝的に変更することはできるが,これらのタンパク質を化学的に修飾することができない。すなわち,生物学的に活性をもつ型に変換できないのである。
また,大腸菌細胞内では正常な高次構造が作られない例も知られている。この問題を解決するために,新しい世代の真核生物宿主が利用されている。この宿主には,家畜や植物も含まれ,薬学的に重要なヒトタンパク質を製造するのに利用されている。

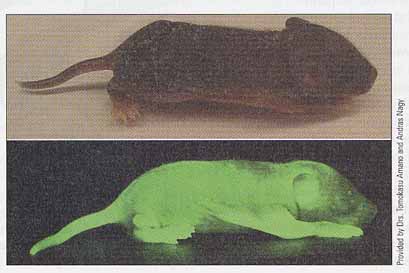
気腫 emphysema ( MIM/OMIM 107400 ) は進行性で,致命的な呼吸器異常を示す。α-1-antitrypsin 遺伝子の突然変異が原因である。この遺伝子産物を作成するために,遺伝子がコピーされ,乳生産を開始する DNA 配列の隣になるようベクターに導入された。この組み換えベクターはヒツジの受精卵に微量注入され,卵は雌ヒツジに移植された。
こうして作られた形質転換ヒツジは正常に発育し,雌ヒツジは α-1-antitrypsin ( 約 40 g/liter ) を含む乳を生産する( 右図 )。このタンパク質は現在臨床試験中で,まもなく供給が開始される。
ヒトの成長ホルモン,ソマトトロピンも大腸菌宿主で作られた医学的に重要な分子の 1 つである。しかし,大腸菌宿主はこのタンパク質の修飾ができないため,利用に当たっては化学的な修飾を施す必要がある。
ヒトソマトトロピン遺伝子を導入した形質転換タバコでは,このホルモンは修飾を受けるので,植物から抽出すると小人症や他の遺伝病に利用可能である。
食べられるワクチンを作る
発展途上国における予防接種計画はしばしば効果が期待できないことがある。その理由は,多くのワクチンは輸送と保存中は冷蔵しなければならないが,これが農村部ではできないことが多い。1992 年に開始された Children’s Vaccine Initiative では,このような国々で使うために,形質転換食用植物を利用した,安くて食べられるワクチンの開発を目指している。
この発想は,経口ワクチン源として果物などの可食部分を用いることである。そうすれば,生産,純化,流通など生産工場への投資が必要なくなるので,ワクチンは安くなるだろう。さらに,内科医によって,無菌的な状態で注射する必要もない。まず,毎年 3 百万の子供たちが死亡している幼児性下痢症に対するワクチンの開発が目指されている。
タバコがモデル植物として利用され,B 型肝炎ウイルスに対するワクチンが開発されている。下痢症に対するボランティアの臨床試験では,調理しない形質転換ジャガイモを食べて,接種効果があることが確認されている。
さらに試験され結果がよければ,B 型肝炎ウイルスや下痢症に対するワクチンが,バナナや生で食べられ,世界中で栽培されている他の植物に移植されるだろう。近い将来,多くの感染症に対する幼児,子供ならびに大人の予防接種に遺伝子工学植物が利用されるだろう。
食料作物への遺伝子導入
 |
| 昆虫の被害を受けた無処理の綿花と( 右 )と被害のない GM 綿花 ( 左 ) |
|---|
農作物として重要なものに遺伝子導入して形質転換作物が作出されている。導入される遺伝子は他の植物種や細菌に至るまで利用されている。
遺伝子導入によって,作物に昆虫や除草剤に対する抵抗性を高めるなどの新しい形質を付与する。このような植物は一般に,遺伝子組み換え生物?genetically modified organism ( GMO ) とか?遺伝子組み換え作物?と呼ばれる。
すべての作物が,自然淘汰や交雑によって,何千年にもわたって遺伝的に変化してきた事実が無視されることを意味する。
雑草防除に用いられる除草剤に対する抵抗を高めた形質転換作物や昆虫に対して抵抗性をもった作物が今できている。農家は年間 100 億ドル以上の費用をかけて,100 種を超える除草剤を利用いている。それにもかかわらず,世界的に見てすべての作物の 10% 以上が雑草によって打撃を受けている。
除草剤に対する抵抗を高めた形質転換作物は glyphosate や glufosinate などの広範囲の除草剤に対する抵抗性に対する遺伝子を獲得している。これらの除草剤は,圃場の作物以外すべてを枯らし,土壌で速やかに分解して,流出や環境に対する影響を低減する。
トウモロコシ,コットン,ジャガイモなどの作物では害虫に対する抵抗性が遺伝子工学的に付与されている( 右図 ) 。
これらの作物は毒素を作る細菌の遺伝子を獲得している(Bt 作物と呼ばれる )。この毒素が昆虫の腸に放出され,死に至らしめる。
いくつかの新しい形質転換作物が開発中で,近い将来利用されるだろう。たとえば,
- 耐塩性トマトは灌漑用水や土壌中の塩濃度が高い地域で発育するように考え出された。
- ゴールデン米はビタミン A の前駆物質を合成できるようにした形質転換米で,他の品種と交配中で,1 – 2 年のうちには利用できるようになるだろう。
- ビタミン E 含有量を高めた形質転換カノーラも開発中である。
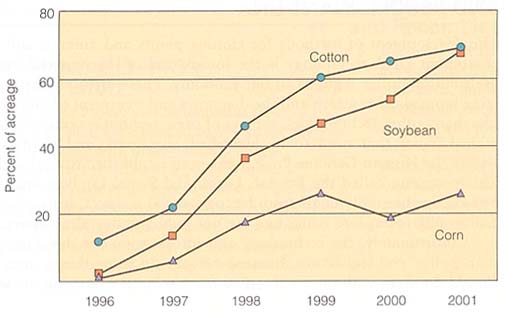
最初の形質転換作物は 1996 年に栽培された。米国における 3 年間にわたる 3 種類の形質転換作物の栽培面積を下に示す。世界的に見て,形質転換作物の作付面積の割合は 2000 年に 11% に増加している。
形質転換作物の開発と利用に関しては多くの意見や疑問がある。形質転換作物がより一般的になり,また新たに開発されているので,健康や環境問題の危険性を考慮する必要がある。
疾病モデルとしてのトランスジェニック動物
遺伝子導入技術は遺伝子病や感染症などの,疾病の動物モデルを作出するために用いられている。たとえば,常染色体優性形質として遺伝し,神経変性を起こすハンチントン病 Huntington disease( MIM/OMIM 143100 )のマウスのモデルが作られている。
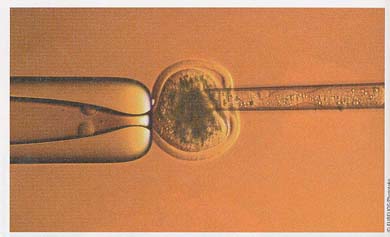
- 最初に,HD 遺伝子のコピーを遺伝子発現を制御するプロモーター配列の隣のベクターに挿入する。
- プロモーター領域の隣に挿入した遺伝子は神経組織や他の器官で発現することになる。
- 次に,HD 遺伝子を運ぶベクターをマウス接合子の核に微量注入する( 右図 )。
- 注入されたマウス卵は受胚雌に移植される。
- 最終的には,新生子マウスの尾部先端から DNA を採取し,サザンブロットか PCR で HD 遺伝子の存在を調べ,遺伝子型を特定する。
| 表 4. 疾病の動物モデルの例 |
|---|
| アルコール中毒症 Alcoholism |
| 筋萎縮性側索硬化症 Amyotrophic lateral sclerosis |
| アテローム性動脈硬化症 Atherosclerosis |
| 心臓肥大 Cardiac hypertrophy |
| 大腸ガン Colon cancer |
| 家族性アルツハイマー病 Familial Alzheimer disease |
| ハンチントン病 Huntington disease |
| 肺ガン Lung cancer |
| 前立腺ガン Prostate cancer |
- この遺伝病の表現型と脳組織の変化との関連を研究するために
- この異常に伴う分子的変化を研究するために,あるいは
- 治療に用いる薬品の試験を行うために
活性 HD 遺伝子をもつマウスが利用される。同様の方法によって,いろいろな疾患モデルが作出されている( 表 4 )。
クローン作出と組み換え DNA 技術に関する倫理的な問題
動植物のクローン作出方法の開発や組み換え DNA 技術の利用は,大規模なバイオテクノロジー産業の基本である。これらの手法が,生物医学研究や疾病の診断と治療に大きな変革をもたらしている。他の多くの技術と同様に,これらの技術の利用によって重大な社会的ならびに倫理的な問題が生じている。これについては今後十分認識して議論をし,解決していかなければならない。
ヒトゲノム・プロジェクト内にもこの問題を扱う機関が設立されている。Ethical, Legal, and Social Implications ( ELSI ) プロジェクトである。
残念ながら,技術と情報は政治と立法より早く発展する。「 我々が何かできる 」ということは「 我々が社会の合意なしにそれをすべきである 」ということではない。
- ヒトクローン作成を生殖介助術の一つとして容認すべきか?
- 将来の世代の遺伝構成を ( 彼らの同意無く ) 改変してしまう生殖細胞に対する遺伝子導入を許可すべきか?
- 遺伝病の治療ではなく,個人の改良のために遺伝子治療を用いるべきか?
- 背の小さい子供たちは平均身長に達するために,組み換え DNA 技術で生産した成長ホルモンの投与を受けるべきか?
- 異常に背の低い子供に処置が認められるなら,プロのバスケットボール選手になる夢を叶えようとして正常な背の高さの子供たちに処置するのは倫理的か?
米国食品医薬局の現在のガイドラインでは組み換え DNA 技術によって生産された食品にそれを示す表示は義務づけられてはいない。
- そのような食品に表示をすべきか?
- もしそうなら,その理由は何か?
食品は何千年もの長い間遺伝的操作を受けてきたのであり,遺伝子導入はそれを単に拡張するものだということもできる。また,消費者は遺伝子導入によって食品が改変させていることを知る権利と必要性をもつとも主張できる。
これらの問題に関して,法的,道徳的,ならびに倫理的な意味合いを熟考する必要があろう。
| 最初に戻る |
| メニューのページへ戻る |
February 06, 2020