遺伝子導入動物 Transgenic Animals
| このページの内容 |
遺伝子導入動物とは,ゲノムに外因性の遺伝子が挿入された動物のことをいう。外因性の遺伝子は 組み換え DNA recombinant DNA 技術によって作成される。構造遺伝子 に他の塩基配列が付加され,
- 宿主の DNA に組み込まれ,
- そして宿主の細胞によって正確に発現されるように工夫されている。
- 遺伝子導入ヒツジや 遺伝子導入ヤギは,乳汁中に外因性のタンパク質を発現するように作出されている。
- 遺伝子導入ニワトリは,卵の卵白成分にヒトのタンパク質を合成して,供給源となってくれる。
| 2000年 7 月,ドリー を誕生させた研究者らは遺伝子導入ヒツジの作出に成功したと報告した。このヒツジでは,導入遺伝子はゲノムの特別な部位に挿入され,十分な機能が確認されている。[ 詳細についてはこちら ] |
遺伝子導入マウスは多くの生物学的な問題を研究する際の良い実験ツールとなっている。
例:
通常のマウスはポリオ・ウィルスに感染しない。そのウィルスの受容体として ヒトで 認められる細胞表面分子がマウスでは欠損しているからである。
したがって,通常のマウスは,この疾病を研究するための安価で,容易に操作できるモデルとして役立たない。しかしながら,ポリオ・ウイルス受容体に対するヒト遺伝子を発現できる遺伝子導入マウスは,
- ポリオ・ウイルスに感染し,
- さらに,ヒトで見られるような麻痺や他の病理学的な変化を示してくれる。
遺伝子導入マウスを作製する 2 つの方法
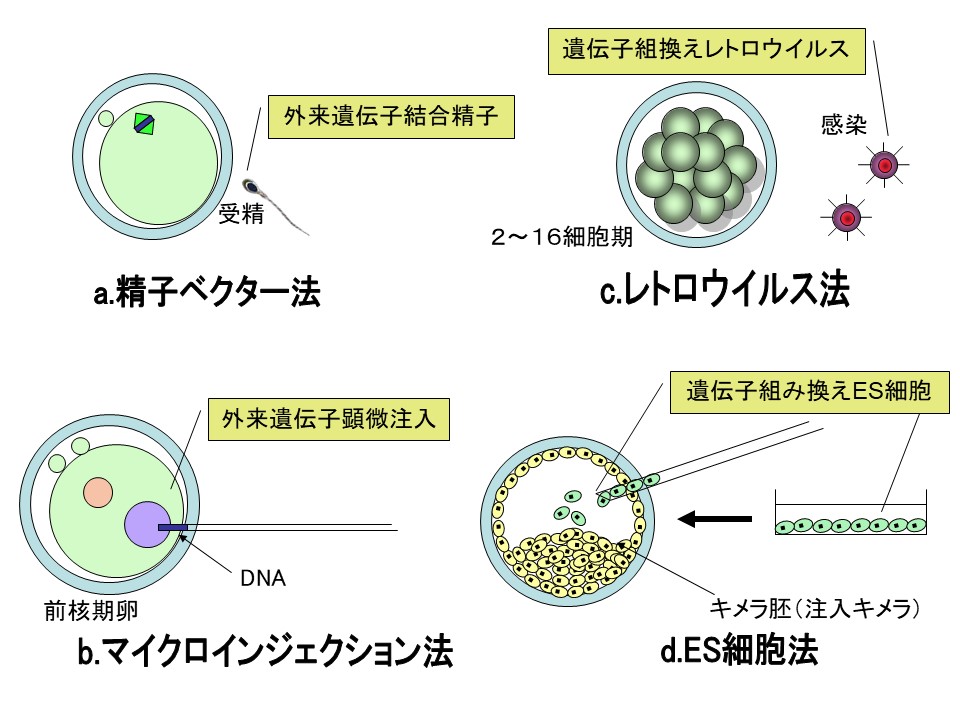
- 体外培養で増殖している 胚性幹細胞 embryonic stem cell ( ES cell ) を目的の遺伝子と共に培養し,DNA の導入を図る。
- マウス受精卵 ( 前核期 ) の 前核 pronucleus へ目的の遺伝子を注入する。
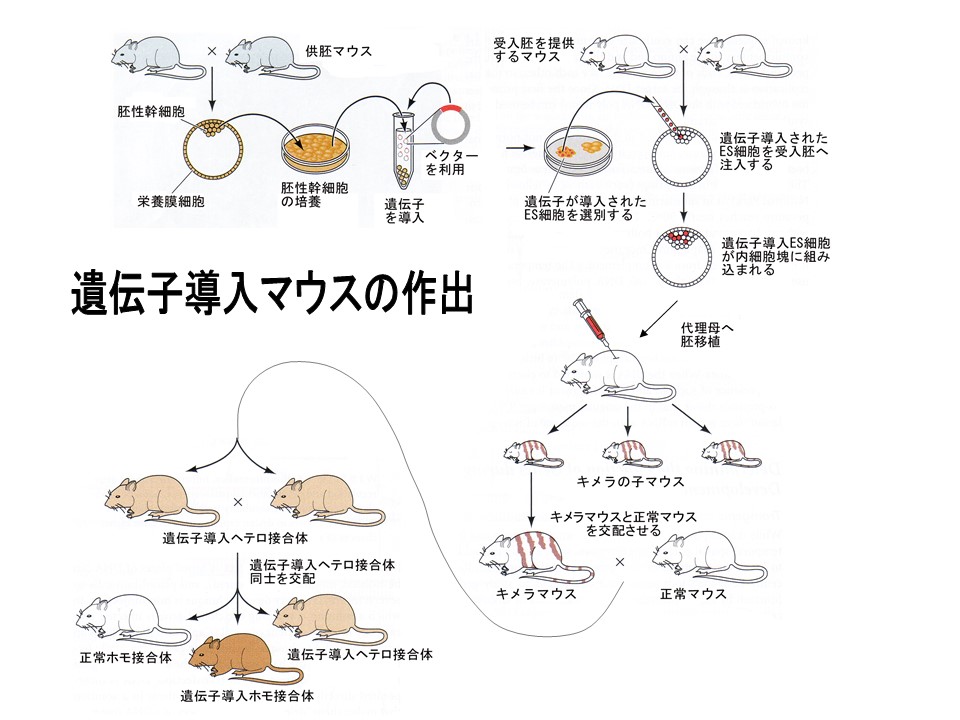
胚性幹細胞 Embryonic Stem Cell を用いる方法 ( 方法 1 )
胚性幹細胞 ( ES cell ) はマウス胚盤胞の 内細胞塊 inner cell mass ( ICM ) から樹立する。胚性幹細胞は体外培養で増殖し,配偶子 を含む個体のすべての細胞に分化する能力を保有している。
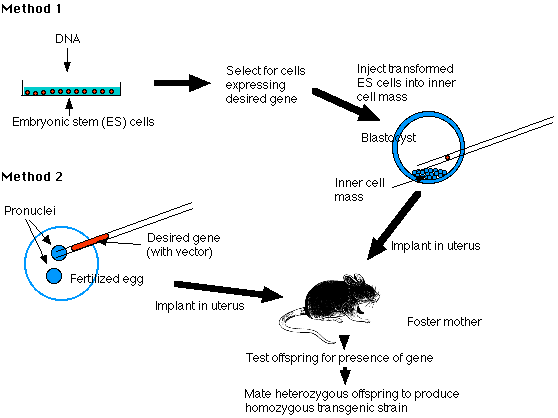
1. DNA を作製する
組み換え DNA 技術により,以下を含む DNA 分子を作製する:
- 目的としている構造遺伝子 ( たとえば,インスリン遺伝子 )
- 宿主細胞の DNA 分子へ挿入しやすくする ベクター DNA
- 導入された遺伝子が宿主細胞で発現できるようにする プロモーターとエンハンサー 配列
2. 培養中の ES 細胞に遺伝子を導入する
培養細胞を DNA に暴露することで,細胞が DNA を取り込むようにする。
3. 遺伝子を組み換えた細胞の選別 [ 方法についてはこちら ]
4. マウス胚盤胞の内細胞塊にこれらの細胞を注入する
5. 胚移植
- 偽妊娠 マウスを準備する ( 精管結紮オスとの交配による ) 。交配の刺激によって,ホルモン変化が引き起こされ,メスの子宮の着床の準備が始まる。
- 子宮に胚移植をする。
- 着床 後,出産(出生率は1/3以下)するのをまつ。
6. 新生子の DNA 検査
- 尾端から少量の組織を採取して,導入した遺伝子が発現しているかを検査する。発現するのは 10 -20% に過ぎない。産子は当該の遺伝子の ヘテロ接合体 となる。
7. 遺伝子導入系統を樹立する
- ヘテロ接合体同士を交配させ,その産子を調査する。産子の 1/4 が導入した遺伝子に対する ホモ接合体 となるものと期待される。
- これらの交配により遺伝子導入系統が得られる。
前核注入法 ( 方法 2 )
1. 方法 1 と同様に DNA を準備する
2. 受精卵にDNAを注入する
- 精子頭部が前核に変換した時期の受精卵を回収する。
- 雄性前核に導入 DNA を注入する。
- 雌雄前核が融合して, 2 倍体の核を形成し,接合体が 2 細胞期胚に有糸分裂する。
3. 受胚雌に移植して着床を待ち,方法 1 と同様に処理を進める。
例

この写真は遺伝子導入マウス ( 右側 ) と正常な同腹子 ( 左側 ) を示す。巨大なマウスは以下の組み換え DNA 分子で形質転換された卵子から発生したものである。
- ヒト 成長ホルモン growth hormone の構造遺伝子
- 機能的なマウス遺伝子の プロモーター
遺伝子導入マウスの血中成長ホルモンの量は対照マウスの数百倍であった。
無作為の遺伝子挿入とターゲット遺伝子挿入
遺伝子導入に用いられていた初期のベクターは遺伝子 ( 1 - 200 コピー ) をゲノムの “どこか” に挿入してくれる。しかし,特定の遺伝子の付近の DNA 配列が分かれば遺伝子を置換するベクターを作ることが可能である。遺伝子置換は次の目的のために用いられる:
- 突然変異動物における機能を回復させる。
- 特定の遺伝子座を機能しなく(ノックアウト )する。
いずれの場合でも,ターゲット遺伝子挿入には次のことが必要である:
- 導入する遺伝子
- neor 遺伝子:抗生物質ネオマイシン(ならびにその同族物質*)を不活化させる酵素をコードする遺伝子。*たとえば,哺乳動物細胞に致死的な薬剤G418
- tk 遺伝子:チミジンキナーゼ をコードする遺伝子。チミジンキナーゼはヌクレオシド類縁物質ガンシクロビル gancyclovir をリン酸化する酵素。 DNA ポリメラーゼ polymerase は結果的にできあがったヌクレオチドを区別せず,この機能を持たないヌクレオチドの中に新たに置換したい DNA を挿入していく。
ステップ 1
培養 ES 細胞をベクター DNA の調整液で処理すると,
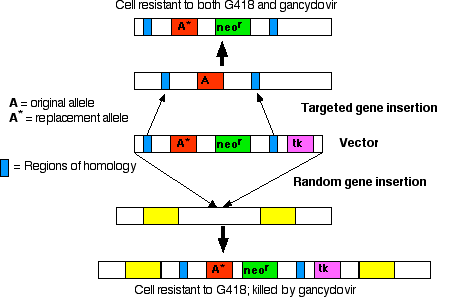
- ベクターを取り込んでいないほとんどの細胞はG418で処理すると死滅してしまう。
- ゲノムに無作為にベクターが挿入された一部の細胞では,tk 遺伝子を含むすべてのベクターが宿主 DNA に挿入されている。これらの細胞はG418に耐性を示すが,ガンシクロビル gancyclovir で死滅する。
- さらに少数ながら,ある細胞では相同性の組み換えが起こる。ベクターの DNA 配列と宿主ゲノムと相同の塩基配列がマッチして,これらの領域で宿主 DNA との置換が起こる。
ステップ 2
G418と ガンシクロビル を含有する培地で培養することによって,
- ベクターを取り込めなかった大部分の細胞はG418の作用によって死滅する (ネオマイシン耐性遺伝子が導入された細胞を選択するので,ポジティブセレクションという) 。
- ベクターが任意に取り込まれた細胞は tk 遺伝子を含むため,ガンシクロビル によって死滅する(tk 遺伝子が導入されなかった細胞を選択するので,ネガティブセレクションという)。
- この方法によって,相同組み換えが成功した細胞集団のみが生き残る。
ステップ 3
マウス胚盤胞の内細胞塊にこれらの細胞を注入する。
ノックアウト・マウス Knockout Mice
置換した遺伝子 ( 図では A* ) が機能を持たない場合 ( “null” 対立遺伝子 ) ,ヘテロ接合体マウス同士を交配することによってノックアウト・マウス系統を作出することができる。機能を持たない遺伝子をホモでもつことになるので,ノックアウトされたという。
ノックアウト・マウスは遺伝子の機能を知る上で非常に有用なツールである。ノックアウト・マウスの研究から 2 つのことが明確になってきた。
- ノックアウト・マウスは,遺伝子の欠損によっても影響が見られない場合がしばしばある。多くの遺伝子は必ずしも必須ではないようである。マウスのゲノムは一対の対立遺伝子が機能しない場合でも,それを補償できる代理機能性をもっているようである。
- 多くの遺伝子は 多面性遺伝子 pleiotropic gene である。異なる組織で,異なる方法で,発生の異なる時期に発現する。
組織特異的ノックアウト・マウス Tissue-Specific Knockout Mice
ハウスキーピング遺伝子がすべての細胞で発現し,エネルギーの代謝や細胞機能の維持するが,適切なシグナル(たとえがホルモン刺激など)によって特定の細胞で,特定の遺伝子が発現する。
そのような遺伝子を研究するために,前項で述べた方法が有力だと期待されるが,成体の特定の組織で発現する遺伝子が,胚発生中の生命維持に機能するものがあることも判明している。この様な場合には,研究対象の遺伝子をノックアウトすると,実験動物が生存できなくなってしまう。
そこで,特定の細胞でのみ特定の遺伝子をノックアウトできる方法が考案された。
Cre/loxPシステム
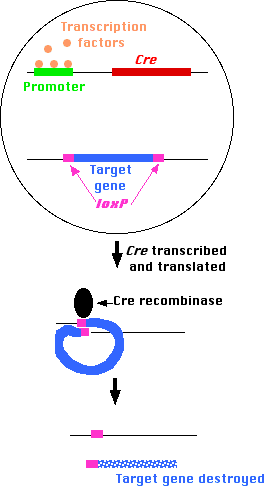
宿主である大腸菌に感染するバクテリオファージP1が作る酵素 Cre が複製したDNAを切り出し,自身のゲノムを環状化して新生ウイルスに分配する。Cre は loxP 配列とよばれる塩基配列を認識しDNAを切断する。2カ所の loxP 配列に挟まれたすべてのDNAは除去され,残存したDNAがお互いに連結される。したがって,この酵素はリコンビナーゼ(DNA組換え酵素)である。
上記の「方法1」を用いて,以下の遺伝子をマウスに導入して形質転換が可能となる。
- その細胞タイプ固有の機能に必要とされる遺伝子発現を刺激するのと同じ転写因子と結合した時だけ活性化されるプロモーターを上流にもつCreをコードしている遺伝子
- 研究したい機能をもち,loxP配列に挟まれた「ターゲット」遺伝子
成体のマウスでは,
- ホルモンまたはサイトカインの出現のようなシグナルを受け,
- 必要とされる転写因子の産生が始まり,そして
- 特定の細胞タイプに必要なタンパク質をコードする遺伝子のプロモーターが活性化された
細胞で Cre 遺伝子の転写が始まり,それによって産生されたタンパク質によって,目的の「ターゲット」遺伝子がノックアウトされる。
他のすべての細胞では, Cre プロモーター(あるいはまた何らかのエンハンサー)に結合すべき転写因子ができない。したがって,「ターゲット」遺伝子は機能したままである。
その結果,特定の細胞でのみ特定の遺伝子がノックアウトされたマウスが誕生する。
ノックイン・マウス
Cre/loxPシステムは,以下の目的にも利用される。
- 遺伝子転写を妨害するDNA配列を取り除くため。
実験者が意図した特定の細胞で,または特定の時間に「ターゲット」遺伝子をオンされることができる。 - マウス自身の遺伝子の1つを研究者が調査したい新しい遺伝子と入れ替えるため。
そのような遺伝子導入マウスは,「ノックイン」マウスと呼ばれている。
遺伝子導入ヒツジとヤギ
最近まで,ヒツジに導入された遺伝子は無作為に挿入され,その発現の程度も低いものであった。しかし,2000 年 7 月に,特異的な遺伝子座への遺伝子導入が報告された。この遺伝子はヒト α1-アンチトリプシン alpha1-antitrypsin 遺伝子であった。そして,2 頭の動物が大量に乳汁中にヒトのタンパク質を分泌したのである。
その方法は以下の通りである。
組織培養で増殖しているヒツジの繊維芽細胞 ( 結合組織 細胞 ) が以下の DNA を含むベクターで処理された。
- ヒツジの COL1A1 遺伝子を含む相同な 2 ヵ所。この遺伝子は タイプ 1 コラーゲン をコード化する ( これが欠損すると遺伝病 骨形成不全症 osteogenesis imperfecta となる ) 。繊維芽細胞が多量のコラーゲンを分泌し,この遺伝子が利用しやすいので,この遺伝子座が選ばれた。
- 導入されたベクターをもつ細胞を分離できるようにネオマイシン耐性遺伝子が用いられた。[ 詳細はこちら ]
- ヒト遺伝子は alpha1-antitrypsin をコード化している。このタンパク質に関わる遺伝子が,全く,あるいはほとんど機能しない人がいる。この場合,α1-アンチトリプシン欠乏症 Alpha1-Antitrypsin Deficiency ( A1AD ) という遺伝病となる。主な症状は肺 ( 時に肝臓にも ) への損傷である。
- β-ラクトグロブリン 遺伝子のプロモーター領域が利用された。これらは乳腺胞細胞におけるホルモン感受性の遺伝子発現を促進する。
- mRNA の効果的な 翻訳 のためにリボソームの結合領域を含む。
導入された細胞は,
- ヒツジの除核された卵と融合され, [ 方法についてはこちら ]
- 受胚雌ヒツジの子宮に移植された。
- 数頭が出産し, 2 頭は 1 年以上生存している。
- ホルモンで処理されると,これらの 2 頭は大量の α1-アンチトリプシン ( 650 µg/ml; 無作為な遺伝子導入によって得られた結果の 50 倍 ) を含む乳汁を分泌した。
遺伝子導入ニワトリ
ニワトリは,
- ヒツジやヤギよりも速く成長し,しかも限られた空間に大羽数が飼育できる。
- 卵の”卵白”に数グラムレベルのタンパク質が合成される。
ニワトリに外来遺伝子を導入する目的で,以下の2種類の方法が成功している。
- ウイルス・ベクターでの感染
ただし,ヒトの治療に必要なタンパク質をコードする遺伝子を結合させたベクターで,卵白のタンパク質を造るシグナルに反応するプロモーター領域をもつもの。 - 雄鶏の精子で受精させる
ヒト遺伝子と適切なプロモーターを付着させた精子
両者の予備試験では,採卵鶏の卵にヒトのタンパク質が 0.1 グラム産生するニワトリが作出されている。
培養容器内でヒトの治療用タンパク質を生産するよりも低コストであるばかりでなく,タンパク質をグリコシル化して適切な糖鎖を付加することも可能であった。なお,大腸菌では糖鎖の付加はできていない。
遺伝子導入ブタ
外来のDNAを取り入れた精子で通常の卵を受精させることによって,遺伝子導入ブタが生産されている。精子媒介遺伝子導入(sperm-mediated gene transfer,SMGT)と呼ばれるこの手法により,人間のための移植臓器の供給源となる遺伝子導入ブタが生産できる可能性があるだろう。
遺伝子導入霊長類
Natureの2009年5月28日号に,日本の研究者が遺伝子導入マーモセットをつくったことが報告されている。マーモセットは霊長類に属し,これまで遺伝子工学に利用されている我々に最も近縁の動物である。
ある研究では,緑色蛍光タンパク質の導入遺伝子が生殖細胞系に取り込まれて,動物の子供たちに遺伝した。これらの遺伝子導入動物がヒトの疾病とその治療方法を研究するために最高の研究モデルになることが望まれている。
March 29, 2020