遺伝子翻訳: RNA → タンパク質
| このページの内容 |
問: ヌクレオチド nucleotide の配列がどのようにアミノ酸の配列を決めていくのだろうか?
答:転移 RNA transfer RNA 分子, すなわちそれぞれが 1 個のアミノ酸と コドン と呼ばれるメッセンジャーRNA( mRNA )分子内における特定のヌクレオチドの トリプレット に対応している。 tRNA 分子ファミリーは mRNA 分子内のコドンを翻訳して,タンパク質のアミノ酸を配列していく。
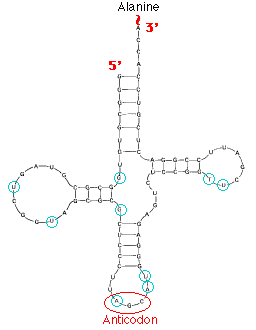
この図は酵母における アラニン転移 RNA alanine transfer RNA ( tRNAala ) の構造を示す。 77 個のリボヌクレオチド一本鎖から成る。一本鎖は折り畳まれ,塩基対の多くがお互いに対応して 4 つのらせん部分を形成している。その構造の中で塩基が対応していない部分はループを形成している( 図の青の円形で囲んだ塩基は RNA 分子が合成された後に化学的に修飾を受ける )。
タンパク質合成に必要な20 種類のアミノ酸には,それぞれ1種類以上の tRNA が対応している。(あるアミノ酸には, 2~3 個の tRNA が使われているので,細胞質には 32 種類以上の tRNA が存在する。) アミノ酸は特定の tRNA に酵素 ( 20 種類のアミノアシル tRNA合成酵素 aminoacyl-tRNA synthetases のうちの 1 つ ) の働きによって結合される。
各種の tRNA は対合していない 3 塩基配列,この部分をアンチコドン anticodon という。この塩基配列が 塩基の相補的な対合 ルールに従って, mRNA 上のコドンを解読する。DNA 複製や転写の時のように,反対方向に配列する塩基との対合が起こる。したがって, mRNA ( 5′ → 3′ ) のコドンの解読は反対方向に配列したアンチコドンによって行われる。
アンチコドン: 3' CGA 5'
コドン: 5' GCU 3'
RNA コドン表
| U | C | A | G | ||
|---|---|---|---|---|---|
| U | UUU Phenylalanine ( Phe ) | UCU Serine ( Ser ) | UAU Tyrosine ( Tyr ) | UGU Cysteine ( Cys ) | U |
| UUC Phe | UCC Ser | UAC Tyr | UGC Cys | C | |
| UUA Leucine ( Leu ) | UCA Ser | UAA ストップ | UGA ストップ | A | |
| UUG Leu | UCG Ser | UAG ストップ | UGG Tryptophan ( Trp ) | G | |
| C | CUU Leucine ( Leu ) | CCU Proline ( Pro ) | CAU Histidine ( His ) | CGU Arginine ( Arg ) | U |
| CUC Leu | CCC Pro | CAC His | CGC Arg | C | |
| CUA Leu | CCA Pro | CAA Glutamine ( Gln ) | CGA Arg | A | |
| CUG Leu | CCG Pro | CAG Gln | CGG Arg | G | |
| A | AUU Isoleucine ( Ile ) | ACU Threonine ( Thr ) | AAU Asparagine ( Asn ) | AGU Serine ( Ser ) | U |
| AUC Ile | ACC Thr | AAC Asn | AGC Ser | C | |
| AUA Ile | ACA Thr | AAA Lysine ( Lys ) | AGA Arginine ( Arg ) | A | |
| AUG Methionine ( Met ) or 開始 | ACG Thr | AAG Lys | AGG Arg | G | |
| G | GUU Valine Val | GCU Alanine ( Ala ) | GAU Aspartic acid ( Asp ) | GGU Glycine ( Gly ) | U |
| GUC (Val) | GCC Ala | GAC Asp | GGC Gly | C | |
| GUA Val | GCA Ala | GAA Glutamic acid ( Glu ) | GGA Gly | A | |
| GUG Val | GCG Ala | GAG Glu | GGG Gly | G |
注記:
- アミノ酸のほとんどは同義コドン( 1文字目と2文字目の塩基が共通で,3文字目だけが異なる場合が多い )によってコードされている。
- ある場合には, 1 つの tRNA がこれらの 2 つ以上の同義コドンを認識できる。
- 例:アンチコドン 3′ AAG 5′ をもつ phenylalanine tRNA は UUC だけでなく UUU も認識する。
- コドンの 3 番目のヌクレオチドでは,アンチコドンの塩基とややルーズな対合 (wobble pairing,例えば G と U の対合 ) が許されるという複雑さ(ゆらぎ仮説)も存在する。
- コドン AUG は 2 つの関連した機能を持つ
- これはすべての解読の始まりを意味する。すなわち,合成されるポリペプチドの アミノ末端 amino terminal にアミノ酸 メチオニン methionine をセットし 翻訳 の始まりを合図する。
- 遺伝子内部にこのコドンがあれば, アミノ酸の1つである メチオニン を導入するように働く。
- 3つのコドン, UAA, UAG, ならびに UGA は翻訳の終了を告げる合図として働く。これらはストップ・コドンと呼ばれる。
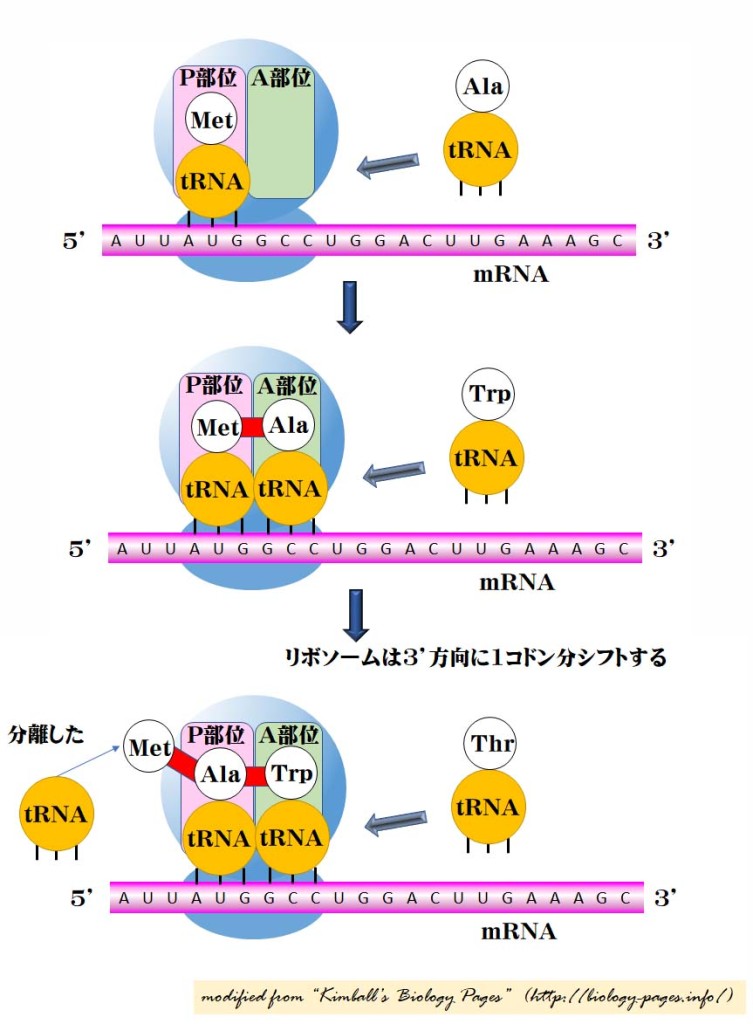
翻訳のステップ
1. 開始
- リボソームの小サブユニット small subunit が翻訳開始部位の上流部( 5’末端 )に結合する。
- 開始コドン AUG を認識するまで下流方向 ( 5′ → 3′ ) へ移動する。( mRNA キャップとAUGとの間の領域は 5′ 非翻訳領域 [5′-UTR] と呼ばれる。)
- ここで,大サブユニット large subunit と 特別な開始 tRNA initiator tRNA が共同し始める。
- 開始 tRNA がリボソームの P 部位 P site ( 図ではピンク ) に結合する。
- 真核生物では,開始 tRNA が メチオニン methionine ( Met ) を運び込む。 (細菌では修飾されたメチオニン N-formylmethionine( fMet )が用いられる。)
2. 伸張
- アミノアシル tRNA aminoacyl-tRNA ( そのアミノ酸に共有結合した tRNA )が, A 部位 ( 図には緑で示してある ) に到達し mRNA 上の隣のコドンと塩基対合する。この部位では,以下の因子が働く:
- 伸長因子 elongation factor ( 細菌では EF-Tu,真核生物ではEF-1 と呼ばれる )
- GTP ( 必要とされるエネルギー源 )
- 前のアミノ酸は ( 翻訳開始点では Met ) が次に来るアミノ酸と ペプチド結合 ( 図では赤で示している ) して,連結していく。
- 開始 tRNA は P 部位から離脱する。
- リボソームが下流方向へ 1 コドン移動する。
- これによって,ペプチドを着けたまますでに到達した tRNA を P 部位へ移動し,新たに到達するアミノアシル tRNA のために A 部位を開ける。
- 他のタンパク質,伸張因子 elongation factor ( 細菌では EF-Tu,真核生物ではEF-1 と呼ばれる)と GTP のエネルギーによって,この最後の段階は促進される。
注記: 開始 tRNA は P 部位に直接結合できる唯一の tRNA分子である。P 部位とは,peptidyl-tRNA 分子を結合させるという意味の名称である。すなわち,伸張したペプチドを付着させた tRNA の結合部位ということである( 開始 tRNA はこの唯一の例外である )。
A 部位とは,新たに到着した aminoacyl-tRNA,すなわち次のアミノ酸を運んできた tRNA の結合部位という意味である。そのため,たとえばポリペプチドの配列の中に Met を運ぶ tRNA は A 部位にます結合することになる( 開始 tRNA は P 部位に直接結合するが,この場合は異なり,他のアミノ酸 tRNA と同じように移動する)。
3. 終了
- 翻訳の終了は リボソームにストップ・コドン ( UAA, UAG, UGA ) が到達して,伝達される。(この部位からポリ(A)尾部へのヌクレオチドが mRNA の 3‘ 非翻訳領域 [3′-UTR] を形成する。)
- ストップ・コドンに対応するアンチコドンをもつ tRNA 分子はない。
| ( 2 – 3 の特別な例外がある: ミトコンドリア遺伝子 と 特殊なアミノ酸 についてはこちら ) |
- しかし,終結因子 release factor と呼ばれるタンパク質が終止コドンが A 部位に到達したことを認識する。
- これらのタンパク質がGTPと共に結合することによって,リボソームからポリペプチドが放出される。
- リボソームはそれぞれのサブユニットに分解して,次のタンパク質合成の時にまた組み立てられる。
| 外部リンク 「DNAの翻訳」アニメーションはこちら Adobe の Flash Player が必要です。 |
ポリソーム polysome
1 つの mRNA 分子上ではポリペプチド合成のいろいろな段階にあるリボソームが多数結合して働いている。 この複合体はポリリボソーム,通常 ポリソーム polysome と呼ばれている [ 電子顕微鏡写真はこちら ]。
コドンバイアス Codon Bias
2つのアミノ酸( Met と Trp )を除くほとんどのアミノ酸には複数のコドンが対応している。しかし,ほとんどの生物のゲノムでは特定のコドンが他に比べ多用されていることがある。
たとえば,ヒトにおいてアラニンはGCGに比べ4倍も多くGCCでコードされている。これはおそらくリボソームにおける特定のコドンに対する翻訳効率が優先されているためであろう。
- 翻訳の開始時点で,2つ以上ある同義のコドン(例えば、ロイシンを取り込むコドンは6つある)は交互に使われる。ロイシンの異なる tRNA を次々に探して使っていくと翻訳効率が遅くなる。
- これによりポリイソームのリボソーム上でお互いに鉢合わせしないようにしてくれるだろう。
- リボソームから出てきた正に生成されて間もないタンパク質が正しく高次構造が取れるよう時間を見計らっているようでもある。
- ひとたび翻訳が良好に進行すれば(30個~50個のアミノ酸が追加された場合には),一つの特定のコドンがそのアミノ酸が必要な度に選択される傾向がある。おそらく,そうすることで転写速度が増加するはずである。
- ほとんどの生物は61種類のコドンに対応する tRNA をコードするには61個以上の遺伝子が必要となる(我々は270個の tRNA 遺伝子をもっている)。同一のアンチコドンをもつ tRNA の同義遺伝子の働きにより,特定のコドンと結合できる tRNA の濃度を増大できる。とくにこれらの活発な遺伝子,それらの mRNA は,そのアンチコドンに対応した多量の tRNA に対応した特定のコドンを多用する傾向がある。
コドンバイアスはコドンの組合せにも及ぶ。すなわち,ヒトのタンパク質が Ala-Glu のアミノ酸配列をもつとすると,これらのアミノ酸をコードする遺伝子は, GCCGAA のコドン配列よりも,同義コドンである GCAGAG が7倍も多く使われている。
コドンバイアスは、望ましい産物の生産性を改善するために,バイオテクノロジー産業によって利用されている。 コドンバイアスを操作する技術により,より安全なワクチンの時代の到来を告げているようだ。
品質管理機構 Quality Control
不完全な mRNA が以下の要因で造られることがある。
- 遺伝子の突然変異
- (極めて低率ではあるが)転写の過程でのエラー
アミノ酸に対して不正確なコドンをもつ mRNA の産生に加えて,次のエラーによって mRNA 分子が造られることがある。
- 未成熟終止コドン Premature Termination Codons (PTCs) 正常な終止コドンより5′末端側に出現した終止コドン。このような mRNA の翻訳により,無効であったり,異常な作用をもつ短縮タンパク質が造られることがある。センスコドンが終止コドンに変化したナンセンス突然変異や翻訳の読み枠がずれた場合に出現する終止コドンとなることもある。この様な問題は,ナンセンス変異依存mRNA分解機構 Nonsense-mediated mRNA decay (NMD)によって解決されることがある。
- ストップ・コドンをもたない。 この場合,転写が終結しない事態となる。転写が終結しない mRNA を分解してしまうノンストップ型mRNA分解 Nonstop mRNA Decay (NSD)が解決する。
ナンセンス変異依存mRNA分解機構 Nonsense-mediated mRNA decay (NMD)
未成熟終止コドン Premature Termination Codons (PTCs) が以下の理由で生成される。
- ナンセンス突然変異
- フレームシフト突然変異
- RNA プロセッシング RNA processing ( イントロンの除去 ) におけるエラー
- B 細胞と T 細胞の抗原受容体を形成する塩基配列のいろいろな組み合わせの中に,比較的高率に出現することがある。この場合,残りのコドンが意味のないものになってしまう。
作用機序
- 核内における RNA プロセッシングの間,隣接するエクソンがお互いに連結される部位でタンパク質複合体が付加される。(これらは mRNA が細胞質に移動するために重要な信号である。)
- 細胞質において,リボソームが mRNA に沿って移動する時,これらの複合体がはずれ( 再利用のために核へ送り戻される )。
- リボソームが未成熟終止コドンに出合うと,最終のエクソン-エクソン間の断片が除去されない。つまり,これは欠陥のある mRNA であることを示すもので,( P ボディ processing bodies, P bodies; PBs において)分解されるように働く。
未成熟終止コドンを生成するような突然変異が嚢胞性線維症 cystic fibrosis とデュシェンヌ型筋ジストロフィー Duchenne muscular dystrophy(DMD)のようなヒトの遺伝性疾患の原因の一つと考えられている。
PTC124またはatalurenと称される薬剤はナンセンス突然変異により生じた未成熟終止コドンを読み飛ばし,さらに後へとタンパク質合成が続くことを可能とする。
ジストロフィン遺伝子にナンセンス変異を認めるデュシェンヌ型筋ジストロフィー(Duchenne muscular dystrophy:DMD)患者(7~16歳男児)に対する、ataluren治療の有効性と安全性を評価する第III相の国際多施設共同無作為化二重盲検プラセボ対照試験の結果が最近発表されている。
ノンストップ型mRNA分解機構 Nonstop mRNA Decay (NSD)
ノンストップ mRNA は遺伝子として読み出される部位に終止コドンが無い場合にできてしまう。その結果,リボソームは,mRNA を解離するために必要な翻訳終結因子 release factor ( RF ) を補充することができない。
ノンストップ mRNA は RNA プロセッシング中に形成されるが,終止コドンに達する前にポリ(A)鎖が付加されることでできる。
作用機序
終止コドンをもたないノンストップmRNAの問題の解決方法が,真核生物と前核生物では異なる。
- 真核生物 では,リボソームが poly ( A ) 構造の終末で立ち往生している場合,タンパク質は以下のように反応する。
- リボソームが再利用できるように遊離して,
- エラーのあるメッセージ配列を分解してしまう。
- 細菌などの原核生物では,ノンストップmRNAの末端にリボソームが停滞すると特殊なRNAー tmRNA が機能し,ノンストップmRNA分解へのしくみがはたらきはじめる。tmRNA はtransfer RNA(トランスファーRNA) と messenger RNA (メッセンジャーRNA)の両方の特性を持っているためこの名称がある。
- 転移 RNA の機能としてはリボソームの A 部位にアラニン alanine を追加する。
- メッセンジャー RNA の機能としては分子破壊の標的となる 10 個のアミノ酸をコードしている。(ペプチド合成に行き詰まり機能を失ったリボソームを再生する。)
翻訳の制御機構
ほとんどの遺伝子の発現は,それらの 転写 transcription のレベルで制御されている。 転写調節因子 transcription factor ( タンパク質 ) が 遺伝子発現に関与する プロモーター promoter と エンハンサー enhancer のスイッチを入れたり,切ったりする。
しかし,遺伝子発現が翻訳のレベルで制御される例も知られている。
1.mRNA 分解機構の仕組みによる制御
P ボディ processing bodies, P bodies; PBs
Pボディはプロセシングボディの略であり,デキャッピ ング酵素であるDcp1-Dcp2複合体やデキャッピングを促 進する因子が細胞質で形成するmRNA-タンパク質凝集体である。
mRNAは核における転写とスプライシングを経て成熟し, 成熟型mRNAが核外に輸送されて細胞質においてリボソームによる翻訳をうけます。 翻訳に伴ってmRNAの3’末端ポリA鎖は徐々に短縮化され,約10塩基程度になった時点でLsm-Pat1複合体やDhh1といったRNA結合タンパク質がmRNA 3’末端に会合し,mRNPのリモデリングがおこります。
このようなmRNAは凝集体を形成して細胞内の顆粒状構造であるPボディに取り込まれ, 顆粒中に存在するDcp1/2、Xrn1などのRNA分解酵素によって主として5’→3’方向に分解をうけます。
これらのタンパク質凝集体は,以下の手段で mRNA を分解していく。
- キャップ構造を除去する。
- ポリ(A)尾部を除去する。
- 残ったメッセージを分解する(5′ → 3′ 方向に分解していく)。
エクソソーム exosome
エクソソームとは,ほとんどの細胞で分泌される直径 50nm ~ 150nm 程度の膜小胞である。
エクソソーム内にmRNAやmiRNAを含む核酸物質が内包されて他の細胞へと受け渡されている可能性が示されて,今後の成果が注目されている。
2.マイクロ RNA MicroRNAs (miRNAs)
miRNA (microRNA, マイクロRNA) は,microRNA(miRNA)は21-25塩基(nt)長の1本鎖RNA分子であり真核生物において遺伝子の転写後発現調節に関与している。
ヒトゲノムには1000以上のmiRNAがコードされていると考えられている。
miRNAはその標的mRNAに対して不完全な相同性をもって結合し,一般に標的遺伝子の3’UTRを認識して,標的mRNAを不安定化するとともに翻訳抑制を行うことでタンパク質産生を抑制する。
miRNAが介する転写抑制は、発生、細胞増殖および細胞分化、アポトーシスまたは代謝といった広範な生物学的プロセスに重要な役割を担うことが知られている。
3.リボスイッチ Riboswitches による制御
mRNAにアミノ酸 amino acid やビタミン vitamin 類,ヌクレオチドなどの低分子化合物 small molecule compound が結合すると,mRNA の転写が早期に終結したり,スプライシングが変更されて mRNA の完成が妨げられたり,翻訳機構の働きが阻害されたりする。この現象を「転写や翻訳を切り替えるスイッチ」という意味でリボスイッチという。
例:
1.チアミン・ピロリン酸塩(チアミン[ビタミンB1]の活性型)が大腸菌の培地で利用できるならば,
□ 培地の成分からチアミンを合成するために必要な酵素の mRNA にチアミン・ピロリン酸塩が結合する。
□ それらの結合により,mRNA の構造のアロステリック変化が誘導され,mRNA がリボソームともはや結合することができなくなり,結局,酵素への翻訳が阻止される。
□ 大腸菌は,利用できるビタミンを合成するために限られた資源を浪費しないで済むことになる。
チアミン・ピロリン酸塩リボスイッチは、植物、古細菌ならびにアカパンカビでも見つかっている。アカパンカビのリボスイッチは,転写産物の選択的スプライシングによって,ビタミンB1代謝に関与する遺伝子を調節している。(他のリボスイッチは翻訳よりもむしろ転写に作用する)。
2.ビタミンB12が大腸菌の細胞内に存在するならば,
□ ビタミンを培地から取り込むために必要なタンパク質をコードするmRNAにビタミンB12が結合する。
□ ここでもまた,リボソームが結合できないよう mRNA のアロステリック変化を引き起こす。
□ すでに十分保有しているビタミンの輸送体を合成するために,大腸菌は資源を浪費しない済むことになる。
3.あるグラム陽性菌(大腸菌はグラム陰性である)は、リボスイッチで彼らの細胞壁を総合するために必要な糖のレベルを制御する。
この場合,糖の濃度が増加した時に,糖を作る酵素の mRNA に産生された糖が結合し,mRNA の分解機構を作動させ,その酵素(すなわち糖)の産生が終了する。
いくつかのリボスイッチが確認されたことから,生命は初めRNAだけを利用しており,タンパク質はそのあとに現れたという「RNAワールド」の進化上の調節システムの名残りかもしれないと言われている。
4.RNA の温度感受性領域 RNA Thermosensors による制御
細菌のいくつかの種では,特定の mRNA のうち 5′ 非翻訳領域(5’UTR)に温度感受性領域を含んでいるmRNAが見つかっている。
たとえば、熱ショックタンパク質の遺伝子をコードしているmRNAは標準温度では 5′ UTRにループを形成している部分がある。そのため,mRNA はリボソームと結合できず,翻訳されることはない。
しかし、高温にするとループは開き,mRNA はリボソームと結合できるようになり,熱ショックタンパク質は翻訳される。
5.RNA結合タンパク質 Gene-Specific Proteins による制御
ヒトの少なくとも一つの mRNA の翻訳は,一つのタンパク質,すなわちアミノアシル tRNA 合成酵素によって抑制される。
炎症性のサイトカイン・インターフェロン-ガンマ[IFN-γ]に応答して,その合成酵素はその通常の機能(それぞれのtRNAに Glu と Pro を加える)をやめて,その代わりにその翻訳を抑止する mRNA と結合する。
ある細菌では,タンパク質産物が自身の mRNA の更なる翻訳を妨げるようだ(一種のフィードバック阻害)。
リボソームとの更なる関係からmRNAを妨害する部位に,そのタンパク質が結合するために起こる。
まとめ
遺伝子発現は2つのステップで起こる:
- 転写 DNA にコード化された情報を RNA 分子に転写する ( 詳細についてはこちら ), ならびに
- 翻訳 mRNA のヌクレオチドにコード化された女婦方をタンパク質のアミノ酸配列に翻訳する。
真核生物 では,転写と翻訳の過程は空間的ならびに時間的に分離されている。DNA の mRNA への転写は核で,mRNA のポリペプチドへの翻訳は細胞質のポリソームで起こる。
前核生物 ( 核をもたない ) では, 遺伝子発現のこれらのステップは同時に起こる。初期 mRNA 分子は,DNA からの転写が完了する前に翻訳し始める。
| 大腸菌における転写と翻訳が同時に起こっている様子を示すポリソームの 電子顕微鏡写真はこちら |
| 最近 ( 2001 年 8 月 10 日号の Science において,Iborra らによって報告された ),前核生物と真核生物間の差が必ずしも絶対的ではないことが示されている。Iborra らは哺乳動物細胞における 10 – 15% の翻訳は核で起こり,この翻訳の少なくともあるものは mRNA が RNA ポリメラーゼによってまだ合成されている時に( 大腸菌 と同じように )起こることを明らかにしている。 |
March 04, 2020