突然変異
| このページの内容 |
生きた細胞において, DNA は,とくに 複製 されている時 ( 真核生物の 細胞周期 の S 期 ) に 化学的変化を起こすことがある。これらの変化のほとんどはすぐに修復されるが,修復されないものが突然変異となる。すなわち, DNA 修復が失敗に終わった状況 が突然変異なのである。
単一塩基置換 single-base substitution
1つの塩基が,たとえば A が他の塩基に置換した場合である。このような単一塩基置換は 点突然変異 とも呼ばれている。
プリン塩基 purine ( A または G) が他のプリン塩基へ,あるいは ピリミジン塩基 pyrimidine ( C または T ) が他のピリミジン塩基と置換したのであれば,これは トランジション変異 transition という。
プリン塩基とピリミジン塩基間の場合は トランスバージョン変異 transversion という。
ミスセンス変異 Missense mutation
置換した塩基が本来の コドン を変え,異なるアミノ酸への変異となるものを指す。
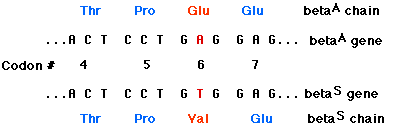
ヒトの第11番染色体のヘモグロビン の β 鎖に関する遺伝子の 17 番目のヌクレオチドの A が T に置き換わると,コドン が GAG ( グルタミン酸 glutamic acid をコードする ) から GTG ( バリン valine をコードする ) に変わる。ミスセンス変異により, ヘモグロビン β 鎖の 6 番目のアミノ酸がグルタミン酸ではなくバリンに置換した例である。
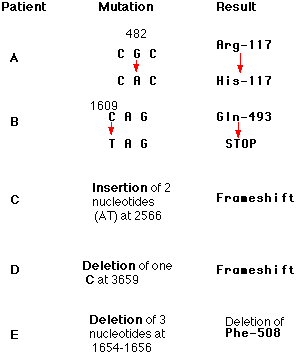
別の例: 嚢胞性線維症 cystic fibrosis をもつ患者 A ( 右図の Patient A を参照 )。
ナンセンス変異 Nonsense mutation
置き換わった塩基のために,特定のアミノ酸を指定するはずが,ストップ・コドンのうちの 1 つ( TAA, TAG, または TGA )に置換した変異である。 そのため,突然変異遺伝子から 転写 されたメッセンジャー RNA の 翻訳 が完了しないままに終結してしまう。この変異が起こるのが遺伝子内で早ければ早いほど,合成されるタンパク質は短く不完全なもので,機能を持たないものとなってしまう。
例:右図の Patient B を参照。
嚢胞性線維症 cystic fibrosis の患者でこれまで認められている変異の例を示す。
これらの突然変異のそれぞれは,嚢胞性線維症膜貫通調節因子 cystic fibrosis transmembrane conductance regulator ( CFTR ) と呼ばれるタンパク質( 1,480 個のアミノ酸から構成される )をコードする巨大な遺伝子内で起こっている。
このタンパク質は塩素イオンと重炭酸イオンを細胞膜を通過して輸送するのに働く。CFTR遺伝子は第 7染色体上に位置し,27のエクソンをもつ約230kbの遺伝子である。
図の「 突然変異 」の欄に示した数字は変化したヌクレオチドの番号を表わす。タンパク質の欠陥のために,様々な症状が現れる。鎌状赤血球貧血の例とは異なり,嚢胞性線維症の場合には複数の突然変異遺伝子を受け継いでいることが多い。
嚢胞性線維症のある患者の例では ( 右図の Patient B ) ,1,609 番目のヌクレオチド C が T に置き換わったために,グルタミンのコドン ( CAG ) がストップ・コドン ( TAG ) に変化してしまった例である。この患者によって産生されるタンパク質は正常な 1,480 個のアミノ酸鎖のうちの最初の 493 個しかないため,正常に機能することはない。
サイレント変異 Silent mutation 非表現突然変異
ほとんどのアミノ酸はいくつかの異なる コドン によってコード化されている。たとえば,セリン serine のコドン TCT の 3 番目が他の 3 種類の塩基の 1 つに変わっても,まだセリンをコード化している。このような突然変異を,遺伝子産物に変化がなく,遺伝子 ( またはその mRNA ) を調べないと検出できないので,サイレント変異といっている。
スプライス部位変異 Splice-site mutation
mRNA 前駆体 が処理されて mRNA が形成される際のスプライシング機構において, イントロン 配列は極めて正確に除去されなければならない。
mRNA 前駆体のスプライシングが転写産物の何処で起こるかは,イントロンに見られる特徴的な配列で決められている。突然変異でこれらの塩基の 1 つが変わると,イントロンが除去されずに最終段階の RNA 分子の一部として残ってしまうことがある。
その配列を翻訳しても,産生されるべきタンパク質の配列とは異なったものとなっている。
挿入 Insertion と欠失 Deletion (インデル Indel )
遺伝子の DNA に余分な塩基対が追加されるか ( 挿入 insertion ),逆に塩基対が除去される ( 欠失 deletion ) ことがある。この場合の塩基の数は 1 個から数千個に及ぶ。挿入または欠失のどちらかあるいは両方を指し,インデル indel 挿入欠失ともいう。
1 つまたは 2 つの塩基対( または2の倍数 )の挿入や欠失によって,遺伝子の翻訳が フレームシフト して( コドンの読み枠がずれて) しまうため,影響が非常に大きい。 右図には,読み枠が右へヌクレオチド 1 個変化したために,同じヌクレオチドの配列でありながらアミノ酸配列が大きく変わる例を示している。
mRNA は 3 個ずつのヌクレオチドの新しい組み合わせで翻訳されるが,これらの新しいコドンによって合成されるタンパク質は本来の機能をもつことはない。上図の他の 2 つの例 ( Patients C と D ) を参照のこと。
フレームシフトによって新たな ストップ・コドン が形成されることがあり,ナンセンス変異 となることがある。この場合も,合成されたタンパク質は本来のものと違いすぎて,細胞には無益なものとなってしまう。
3 個のヌクレオチドまたは3の倍数の挿入と欠失では,コドンの読み枠が保存されているためにそれほど重大な影響を及ぼさないことがある( 上図の Patient E 参照 )。CFTR遺伝子では1,000を越える種類の突然変異が見つかっているが,Patient E の欠失が最もよく見られる例である。
しかし,同一のトリプレットの繰り返しが挿入されることで,多くのヒト遺伝病が起こっている。 ハンチントン病 Huntington’s disease と 脆弱 X 染色体症 fragile X syndrome はこの三ヌクレオチド反復 (トリヌクレオチド反復)によって起こる病気の例である。
脆弱X症候群 fragile X syndrome (FRA X)
ヒトにおけるいくつかの遺伝病では,3個または4個のヌクレオチドが幾度も繰り返して挿入されることによって起こることが知られている。ヒトの X 染色体上には,トリプレット CGG が反復された ( CGGCGGCGGCGG など ) 部位がある。
CGG の反復回数は 5 回程度から 50 回までは有害な表現型は発現しない( これらの反復ヌクレオチドは遺伝子の非翻訳領域にある )。100 回程度の反復でも有害なことはないが,これらの反復は世代毎に( 4000 反復程まで )長くなる傾向をもっている。
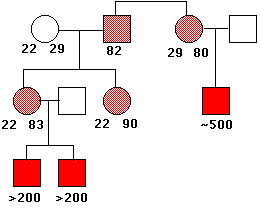
反復回数が多くなると X 染色体は非常に脆弱になり,緊縮するようになる。そのようなX染色体を受け継いだ男性は( もちろん母親から )精神遅延などを含む多くの有害な表現型を示す。
脆弱 X 染色体を受け継いだ女性は(この症候群をもつ男性は父親となることが滅多にないため, ほとんどの場合,母親から脆弱 X 染色体を受け継いでいる )比較的軽微な症状を示す。
右図は,ある家族における脆弱 X 症候群の系統図の例である。トリヌクレオチド CGG の反復回数を各記号の下に示した。この遺伝子は X 染色体上にある。したがって,女性(円形で示してある) は 2 コピーをもち (それぞれの数字が示されている),男性(四角で示してある ) は 1 コピーだけである。80 – 90 反復をもつ遺伝子をもつ人は正常であるが( 薄い赤色 ),この遺伝子は不安定で,反復回数が子孫に伝わると数百に増加してしまう。そのような増大した遺伝子を受け継いだ男性(赤い四角)は脆弱 X 症候群を発症する。(Data from C. T. Caskey, et al.)
ポリグルタミン病 polyglutamine disease
これらの疾患では,反復されたトリヌクレオチドはCAGである。そして,翻訳されたタンパク質にグルタミン(Gln)鎖を付加する。
これらは,以下に示したいろいろな中枢神経系の障害に関与している。
- ハンチントン病 Huntington’s Disease 反復ヌクレオチドが CAG であり, huntingtin とよばれるタンパク質に過剰なグルタミン( Gln )鎖が加わっている。この異常タンパク質は脳の一部における シナプス伝達 を妨害し,これら脳細胞の アポトーシス apoptosis を引き起こす。細胞の機能にどのように影響するのかは不明な点が多い。
- パーキンソン病 Parkinson’s disease タンパク質 ataxin-2 に過剰なグルタミン鎖が付加されている。
筋ジストロフィー Muscular Dystrophy
発症原因は,遺伝子の非翻訳領域中の3塩基配列(CTG)n または4塩基配列(CCTG)n (n はそれぞれの配列のリピート数)が,異常増大することによる。リピート数は,正常では5~37回であるのに対し,数千回以上にまで達すると報告されている。
巨大になったRNA転写産物は,核における他の転写産物の選択的スプライシングを阻害してしまう。
筋萎縮性側索硬化症 Amyotrophic Lateral Sclerosis (ALS)
ALSは,重篤な筋肉の萎縮と筋力低下をきたす神経変性疾患で,有名な患者ルー・ゲーリッグ(MLB選手)から,ルー・ゲーリッグ病(Lou Gehrig’s disease) とも呼ばれる。
第9番染色体の遺伝子にあるヘキサヌクレオチド 6塩基配列 GGGGCC の反復数が,正常では36回程度までなのが,700~数千回まで異常伸張した疾病である。
これらの塩基反復を含むセンス鎖とアンチセンス鎖の両方を翻訳することによって(おそらく3 つの reading frame における,伸長GGGGCC からのnon-ATG から始まる翻訳によって),poly-(Gly-Ala),poly-(Gly-Pro)とpoly-(Gly-Arg)のジペプチド繰り返しタンパク質を含む。
とくにアルギニン(Arg)を含んでいるこれらのタンパク質は、脳細胞に損傷を与える凝集体を形成する。
重複 duplication
重複はゲノムの一部が文字重複したために起こる。減数分裂 meiosis 時に,一直線に整列していない姉妹染色体間で乗り換えが起こり,重複遺伝子をもった姉妹染色体ができてしまい,もう一方では欠失が見られる ( 図では省略 ) 。下に示した例では,釣り合いのとれない乗り換えが起こったため,ステロイドの 1 種である アルドステロン aldosterone の合成に必要な遺伝子が 2 コピーできている。
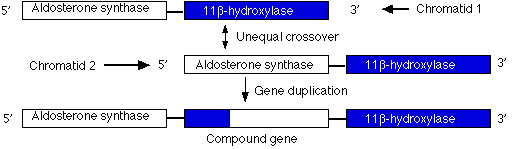
しかし,この新たにできた遺伝子は不適当なプロモーター promoter を 5′ 末端にもつために ( 11-beta hydroxylase 遺伝子から受けとった ) ,通常の遺伝子よりも発現が強くなってしまう。突然変異遺伝子は優性であり,この家族のすべての構成員 ( 4 世代間を通して ) が,高血圧を生じるこの重複をもつ染色体を少なくとも 1 本受け継いでいる。そのため,脳卒中で早死にする傾向が現れている。
遺伝子の重複は真核生物の進化の過程で繰り返し起こった。ゲノム解析によって, 1 つの生物が同じような塩基配列をもつ遺伝子が多数認められている。おそらくこれらの遺伝子は先祖代々の遺伝子が重複を繰り返してきたことに由来すると思われる【 これらをパラログ遺伝子 paralogous gene という 】。
遺伝子重複には,以下のような利点がある。
- 長い間に,重複領域のある部分が新しい機能を獲得することがある。
□ 重複によってコードされたタンパク質が異なる機能をもつことがある。例えば,最初の遺伝子産物が2つの異なる機能(「多面発現」を参照)をもつならば,各々の複製された遺伝子は今1つの機能に専門化することができ,そのため元の遺伝子より多機能となることが可能である。
□ そのようにならなかった場合でも,遺伝子の制御配列(プロモーターやエンハンサー)における変化により,同じタンパク質が異なる時期に,異なる濃度で,あるいはまた異なる組織で発現することもあり得る。 - しかし, 2 個のパラログ遺伝子が同様の配列と機能を持っていると,それらは冗長性( ベルトとサスペンダーのような機能の重複性) を示す。このことが,酵母や “ノックアウト・マウス” などで遺伝子がノックアウトされても認識可能な形で現れない主な理由と考えられる。ノックアウトされた遺伝子の機能はパラログ遺伝子によって受け継がれる。
- 遺伝子重複が起こり,その後これらの遺伝子の一方が任意に欠失したり,不活化したりする。これらの現象がその子孫の別々の集団で起こると,異種交配が避けられる条件となっていく(すなわち,接合後隔離である)。そのような隔離が種分化につながり(二つの遺伝子プールの間での交流が行われなくなり),一つの先祖種から2つの異なる種の進化の可能性が生じる。
転座 translocation
転座は,ある染色体の一部 が非相同染色体 へ転移することを意味する。転座はしばしば相互に起こり, 2 本の非相同染色体間で交換が起こる。
転座によって表現型が変化することがある:
- 遺伝子 内 で転座が起こると,塩基配列の破壊が起こるのでその遺伝子の機能に影響してしまう。
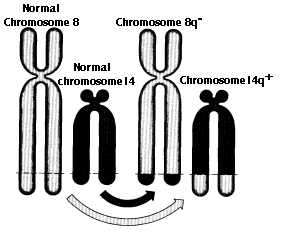
- 転座した遺伝子が異なるプロモーターとエンハンサーの影響を受けるようになり,その本来の発現が変わってしまう。この例として,バーキット・リンパ腫 Burkitt’s Lymphoma の t(8;14) 転座がある。
- 遺伝子 内 に分断点が生じ,2つの遺伝子を融合してしまう例もある。相互転座によって生じた融合遺伝子が転写・翻訳された結果,正常なタンパク質の N 末端をもつタンパク質に他のタンパク質の C 末端が結合したタンパク質が合成される。慢性骨髄性白血病 chronic myelogenous leukemia ( CML ) の患者の白血球にしばしば認められるフィラデルフィア染色体 Philadelphia chromosome がこの融合遺伝子(BCR-ABL遺伝子)を作ってしまうタイプの転座の例である。
突然変異の頻度
突然変異の発生率は低い。これは驚くべきことである。
ヒトは両親から 3 x 109 塩基対の DNA を受け継ぐ。 単一塩基置換 single-base substitution を考えてみると,各細胞は 塩基置換の標的となり得る塩基対を60 億 ( 6 x 109 ) もっていることになる。
DNA が複製される時に最も起こり易いのが単一塩基置換で,真核生物では 細胞周期の S 期 に起こりやすい。
100% の正確度で物事が進行することはまずない。最も優秀なタイピストでも,原稿作成時にエラーが起こり得る。DNA複製においてもエラーは起こり得るのである。勤勉なタイピストのように,細胞にはそのコピーの精度を確認する仕組みをもつが,それでもエラーが残ることがある。
ヒトや他の哺乳動物では,修正されないエラー ( すなわち,突然変異 ) が 5 千万 ( 5 x 107 ) 個のヌクレオチドを引き渡すうちに約 1 回の割合で起こる。(そんなに悪くないじゃないか! それほど正確にタイプを打てればいいなぁ。)
しかし,ヒトの細胞には塩基対が 6 x 109 個あるので,これからいくとそれぞれの新しい細胞には 120 個程度の突然変異が含まれていることになる。
心配すべきだろうか? 何も分からないのに。
我々のDNAの本の1.2%が全タンパク質のエクソンをコードしており,長い間,残りのほとんどはジャンクDNAだと考えられてきた。その部分に突然変異が起こっても,害はほとんどないだろう。
万が一にも翻訳領域が突然変異したとしても,同義コドンがあるので変異遺伝子は同じアミノ酸に翻訳してくれ,同じ機能のタンパク質は造ってくれる。
しかし今,我々のDNAの80%程が,我々の身体を構成する多種類の分化細胞のそれぞれが栄養素やホルモンなどの信号に反応して,どの遺伝子が,どの程度発現すべきかに何らかのかたちで関与しているようである。
したがって,これらの領域で突然変異が起こると,わずかな変異であったとしても極めて有害な影響を及ぼすだろう。
脊椎動物のゲノム配列が決定されるにつれ,タンパク質をコードしていないDNAのある配列にも拘わらず,脊椎動物の進化の過程でかなり保存されてきたことが判明している。
これらの領域の一部は,タンパク質をコードしている遺伝子に比べて突然変異が起こる頻度が低く,これらの配列がこの生物の繁栄に極めて重要であることが示唆されている。
しかし,ゲノムの他の領域は目に明らかな害をもたない点突然変異を維持しているようである。
最近の研究成果から,単細胞生物のゲノムの翻訳領域の塩基配列が決定されている。予備段階の研究成果により,成人の正常細胞ででは約20個ほどの突然変異が蓄積されていて,その変異の種類は細胞ごとに異なっている。(がん細胞では,しばしば数百にも及ぶほどさらに多くの突然変異が蓄積されている。)
表現型を変えてしまう突然変異の頻度についてはどのように測定できるだろうか? ヒトでは簡単ではない。
- 第一に,突然変異が新たに起こっていく状況を確定しなければならない。(ある集団では特定の突然変異が高率で起こるが,その遺伝子がとくに影響されやすかったのではなく,初期の創始者変異が代々伝わってきたためである。)
- 劣性突然変異(それらのほとんど)は父方と母方の双方が同じ突然変異遺伝子である場合にのみ発現する。
- 次の遺伝子の場合には,突然変異頻度を推定できる。
□ 常染色体優性形質
□ X染色体連鎖劣性形質ーX 染色体 上の劣性形質については,男性は 1 本の X 染色体を受け継ぐので,男性にのみ発現する。
表現型に影響を与える突然変異の頻度はどうして測定できるだろうか? ヒトの場合では容易ではない。
- まず,新たに生じた突然変異を確認しないといけない。( ある集団が特定の突然変異を高い頻度でもつことがある。これは遺伝子が特別影響を受けやすいのではなく,ある祖先から何世代にも亘って伝わってきたためである。[ この例についてはこちら ] )
- 両親がその子供の同一の遺伝子座に突然変異を起こす原因になる希な例を除いては,劣性の突然変異 ( それらのほとんどがそうである ) を確認できることはない。ある集団に劣性遺伝子が連続することによってのみ,その突然変異の頻度を推定できる。
- 以下のように遺伝する遺伝子の場合,突然変異頻度を推定できる。
- 常染色体優性
- X-連鎖劣性 ; すなわち,X 染色体 上の劣性形質については,男性は 1 本の X 染色体を受け継ぐので,男性にのみ発現する。
いくつかの症例
配偶子における遺伝子座に起こる突然変異の頻度として表わす。
- 常染色体優性 autosomal dominant
- 網膜芽細胞腫 Retinoblastoma
RB 遺伝子:約百万回に 8 回 ( 8 x 10-6 ) - 骨形成不全症 Osteogenesis imperfecta
タイプ I コラーゲン をコードする 2 つの遺伝子のうちのどちらか: 約 100,000 回に 1 回 ( 10-5 ) - 大腸のポリープ ( 後にガン化する ) になる遺伝的傾向
ガン抑制遺伝子 ( 大腸腺腫様ポリポーシス APC 遺伝子 ) : 約 100,000 回に 1 回 ( 約 10-5 )
- 網膜芽細胞腫 Retinoblastoma
- X-連鎖劣性 X-linked recessive
- A 型血友病
~3 x 10-5 ( 第 8 因子 Factor VIII 遺伝子) - デュシェンヌ型筋ジストロフィー Duchenne Muscular Dystrophy ( DMD )
8 x 10-5 以上 ( ジストロフィン dystrophin 遺伝子 )
なぜジストロフィン遺伝子における突然変異の頻度が他のものに比べて非常に高いのか? これはおそらく大きさの問題であろう。ジストロフィン遺伝子は 2.4 x 106 塩基対の配列からなる DNA である。これはヒトのゲノム全体のほとんど 0.1% になる。そのような巨大な遺伝子には損傷の機会も高くなる。
- A 型血友病
突然変異率を測定する
特定の突然変異(例えば,嚢胞性線維症を引き起こす突然変異)が人口当たりで見られる頻度は,突然変異率の大まかな近似値を与えてくれる。すなわち,新規突然変異率である。これらは偶発性によるもので,これまでにも以下のように重要な要因となっている。
- (正または負の)自然選択
- 機会的浮動
- 創始者効果
さらに,突然変異を集計するためには,表現型に目に見えた突然変異の影響が現れていないといけない。ところが,以下の要因で起こる突然変異は目に見えてこない事例である。
- 非翻訳領域DNAにおける多くの突然変異
- 同義コドンを生み出す突然変異
- 化学的に類似したアミノ酸をコードした新規コドンを生み出す突然変異
- 遺伝子効果を無効にするが,その機能は重複しているために他の遺伝子で補正できる遺伝子の突然変異
しかし,今日,これらの問題は解決された。詳細については,D. R.Denver らによって Nature の2004年8月5日号に報告されている。
Denver DR, Morris K, Lynch M, Thomas WK.: High mutation rate and predominance of insertions in the Caenorhabditis elegans nuclear genome. Nature 430(7000):679-682, 2004.
Denverらの方法
- 実験生物:線虫
- 線虫の利点:
□ ゲノムサイズがコンパクトである。
□ 雌雄同体(hermaphrodite)ー 自ら受精して,新規の生殖細胞変異が両方の相同染色体上で欠失したり出現したり,いずれかが発生する。
□ その世代が短い(わずか4日程度で卵から成虫まで成長する)。 - 異なった198の実験系列が検討されている。
- 自然選択が最小になるように飼育されている。
- 新しい世代ごとに,必ず1匹の子が飼育された。
- 各系統は数百世代維持されていた。
- 実験終了時には,以下の条件のDNAサンプルを分析した。
□ 6本の線虫染色体ごとに複数の部位のDNA配列
□ 198系統について,平均で約21,000個の塩基対の配列が決定され,自然個体群の同一遺伝子座の配列と比較した。
Denverらの結果
線虫から得られたDNA配列(合計で4百万塩基対にも及ぶ)を分析して,対照区と比較して合計30例の突然変異が突きとめられた。
- このうち17例が挿入または欠失(インデル)であった。
□ エクソンにおいて7例ーこのうちの2例ではフレームシフトによる新たなストップ・コドンが出現していた。
□ イントロンにおいて10例 - このうち13例が単塩基置換(点突然変異)であった。
□ エクソンにおいて3例:1例は同義コドンを造るサイレント変異,2例はコードされたアミノ酸が変更してしまった。
□ イントロンにおいて10例
| 線虫ゲノムの特徴 |
| 線虫ゲノムは、およそ1億の塩基配列からなる。コンピュータープログラムにより,現在19,000個の遺伝子がゲノム上で予測されている(驚くべきことにこの数はヒトゲノム上の予測遺伝子数とほぼ同程度である)。 |
Denverらの結果から突然変異率を計算する
これらの結果から,およその偶発突然変異がゲノムを通して起こる率を計算してみた。
突然変異率 = 観察された突然変異の数 [30] ÷ (実験に用いられた系統数 [198] × 平均世代数 [339] × 配列を決定した平均塩基対数 [~21,000] )
以上から,突然変異 2.1 × 10-8 回/塩基対/世代 と計算された。
線虫の全ゲノムは約108 個の塩基対を含んでいるので,毎世代,線虫の2個の半数体ゲノムのそれぞれのどこかで,生殖細胞変異が2回起こるものと推定される。
ショウジョウバエ(そのゲノムは線虫ゲノムとほぼ同じサイズである)における同様の分析でも,同程度の突然変異率が示されている:~10-8 回/塩基対/世代である。
植物シロイヌナズナでは,その偶発突然変異率は、わずかに低く,~10-9 回/塩基対/世代である。
Roach JC. らは,Science 2020年4月30日号で,ヒトにおける突然変異率も同じ範囲にある,すなわち半数体ゲノムの塩基対当たり~1.1 × 10-8 回であることを報告している。
6 × 109個の塩基対の二倍体ゲノムをもつ各々の子供では約70ほどの新しい突然変異が起こるものと算定される。
彼らは、2人の子供たちと彼らの両親の完全なゲノム配列を比較してこれらの数を推定した。
Cellの2012年7月20日号で,Wang J.らは40歳の男性から得られた8個の精子の塩基配列を分析した結果を報告し,突然変異率は 2.0 × 10-8 ~ 3.8 × 10-8 の範囲であることを示している。
そのような偶発突然変異率を心配すべきであろうか?
高すぎるわけではない。
非翻訳領域のDNAの割合が高いので,多くの突然変異は表現型に影響を及ぼさない領域で起こっているだろう。
証拠:8個の精子で検出された251例の突然変異のうち,3例のみがミスセンス変異で遺伝子産物が変更されていた。しかし,非翻訳領域のDNAでも点突然変異は遺伝子の発現に影響するだろう。
そして,子供に遺伝する点突然変異は10%にも及び,わずかだとしても有害な影響を及ぼすだろう。
男性は女性に比べ突然変異の原因になることが多い
ほとんどの突然変異が細胞分裂の S 期に起こるとすると,男性はより危険な状態にある。すなわち,
- 卵子についてみると,女子の胚発生を開始した受精卵から数えてたかだか 24 回程度の有糸分裂を経ているだけで,将来の卵子となる細胞はべつになっている ( 彼女が生まれるはるか前に完了している ) 。
- これに反し,30 歳の男性の精子は,彼を形成した受精卵から数えて少なくとも 400 回の有糸分裂を経た後継細胞であることになる。
したがって,
- 父親が母親に比べると子供に新たな突然変異を伝える可能性が高い。
□ 25歳の男性の精子は45例ほどの新規突然変異が含まれるだろう。この数値は1年ごとに上昇する。したがって,40歳の男性の精子は彼の子供に60例ほどの新規突然変異を伝えることになる。(これらの約20例は翻訳領域で起こっている。)
□ 母親の年齢はどうであろうとも,子供に約15例の突然変異を伝えている。
( ただし,異数性 aneuploidy のような染色体異常は精子でより卵子で起こりやすい。そして,これらの頻度は母の年齢で増加する。 ) - これらのデータから,部分的だが何故,加齢した父親の子供は若い父親の子供に比べると遺伝病を発症することが多いのかが説明される。
体細胞 vs. 生殖細胞の突然変異
同じ突然変異でも,生殖細胞か体細胞で起こるかによって大きく影響が異なる。たとえば,骨髄や肝臓などの 体細胞 somatic cell で起こる突然変異によって,
- 細胞が損傷を受ける。
- 細胞がガン化する。
- 細胞が死滅する。
その影響がどうであれ, 体細胞突然変異 によって最終的にその細胞,あるいは宿主が死亡した時に消滅する運命にある。
これに対して,生殖細胞突然変異 では突然変異した生殖細胞から生じた接合子の後継細胞のすべてに影響が及ぶことになる。 幸い成人に達したとしても,その細胞のすべてが突然変異を含んでいることになる。配偶子も同様である。したがって,親となって子供を得た時には,これらの突然変異が次の世代に受け継がれることになる。
例 1 :
今日,南アフリカに住む 8,000 人以上が ポルフィリン症 porphyria と呼ばれる代謝病の遺伝子をもつ。 それぞれの人は 1 つのカップル, Ariaantje Jacobs と Gerrit Jansz にまで戻る祖先を通してこれらの遺伝子を受け継いでいる。このカップルは 17 世紀後半にオランダから南アフリカへ移住した。 2 人のどちらかが生殖系列を介して彼らの子孫にこの遺伝子を広めてしまったのである。幸い,バルビツール酸系の催眠薬を投与されなければ ( この薬剤は激しい反応を引き起こす ) 症状はたいてい軽微である。
例 2 :
ヒトに起こる網膜芽細胞腫 Retinoblastomaは,
- 散発性 sporadic, これは 2 つの RB 遺伝子のそれぞれの 体細胞突然変異 somatic mutation によって起こる。
- 家族性 familial ( 遺伝するという意味 ),これは両親から生殖系列を介して突然変異 RB 遺伝子をすでにもつ体細胞細胞における変異のために起こる。
その他の関連情報はこちら:
March 18, 2020