| このページの内容 |
タンパク質の細胞内輸送
タンパク質は生命を維持する基本的な物質である,真核生物は膨大な数の機能を持ったタンパク質を合成する。たとえば:
- 細胞質のいろいろな構成成分を形成する ( たとえば,微小管, 解糖系酵素 ) 。
- 細胞膜に埋め込まれて細胞の表面に露出する受容体や他の分子を形成する。
- ミトコンドリア ( 植物の場合には葉緑体 ) の構成成分を供給する。
- 細胞から他の細胞や組織へ必要なものを供給する ( たとえば,細胞を支持するコラーゲン,細胞へ信号を送るホルモン )。
すべてのタンパク質は,リボソーム RNA ( rRNA ) の分子内にコード化された情報に基づきリボソームで合成される。この仮定は翻訳と呼ばれ,その詳細については 遺伝子翻訳 を参照して欲しい。このページでは合成されたタンパク質がどのように必要とされる部位に送り届けられるのかを見てみよう。
タンパク質のいろいろな行き先は,次の 2 つの集団で決まる:
- 細胞質内に浮遊する リボソーム によって合成されるタンパク質の集団
- 小胞体 endoplasmic reticulum ( ER ) 膜に結合するリボソームによって合成されるタンパク質の集団
リボソームにおいて mRNA からポリペプチドへの翻訳が開始される時に,細胞質に浮遊したリボソームで行うか,小胞体に結合したリボソームで行うかがまず決定されることになる。
小胞体への経路
小胞体へ入るかどうかは伸張中のポリペプチドにある シグナル配列 signal sequence の存在によって決まる。
シグナル配列
シグナル配列は伸張するポリペプチド鎖の最初の部分を構成する ( したがって,シグナル配列はペプチドの アミノ末端 にみられる ) 。典型的なシグナル配列は 15 – 30 個のアミノ酸を含む。 このアミノ酸配列はタンパク質によって驚くほど多種多様であるが,すべてのシグナル配列は 多量の疎水性アミノ酸を含んでいる。
| 1999 年度のノーベル賞生理医学賞は,タンパク質がそれらの目的地に到着できるシグナル配列とその他の固有シグナルを発見した業績に対して,1999 年 10 月 11 日に Günter Blobel 博士に贈られた。 |
シグナル配列が 存在 すると,
- 分子シャペロン molecular chaperone と呼ばれる他のタンパク質が小胞体内腔に存在しており,これが伸張中のポリペプチドに結合して,正常な 三次構造 を形成するのを助ける。
- タンパク質に糖鎖が付加される。この過程を グリコシル化( 糖鎖形成 )と呼び,これにより糖タンパク質が合成される。
小胞体内で合成されたタンパク質の行き先
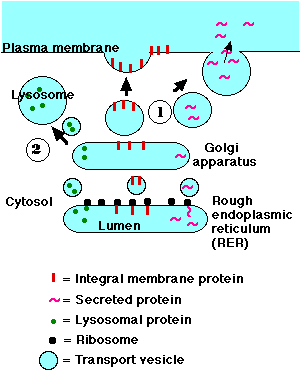 小胞体内で合成されたタンパク質は ゴルジ装置 に輸送される。小胞体の一部が千切れて,輸送小胞 を形成し,タンパク質はこれに含まれゴルジ装置に運ばれる。輸送小胞の膜がゴルジ装置の膜と融合し,その内容物が一つになる。それ以降のグリコシル化はゴルジ装置で起こる。グリコシル化の正確なパターンがタンパク質の最終的な行き先を決定する。これには 2 つの選択肢がある。
小胞体内で合成されたタンパク質は ゴルジ装置 に輸送される。小胞体の一部が千切れて,輸送小胞 を形成し,タンパク質はこれに含まれゴルジ装置に運ばれる。輸送小胞の膜がゴルジ装置の膜と融合し,その内容物が一つになる。それ以降のグリコシル化はゴルジ装置で起こる。グリコシル化の正確なパターンがタンパク質の最終的な行き先を決定する。これには 2 つの選択肢がある。
- マンノース – 6 – リン酸基でグリコシル化されたタンパク質は輸送小胞でもってゴルジ装置を離れ,最終的に リソソーム と融合する ( 右図の経路 2 )。
- このマーカーを受けとらなかったタンパク質は輸送小胞でもってゴルジを離れ,細胞膜 と融合する ( 右図の経路 1 )。 それらは:
- 細胞の表面に露出する膜内在性タンパク質(受容体などを形成する)となる。また,
- 輸送小胞内の可溶性タンパク質は分泌液となり,細胞から放出される。この分泌過程を エキソサイトーシス( 吐細胞現象 )と呼んでいる。
シグナル認識粒子 Signal Recognition Particle ( SRP )
哺乳動物細胞のシグナル認識粒子は,以下のように構成されている:
- 単一の RNA 小分子 ( 7S )
- 6 種類の異なるタンパク質
これらには,以下のものの結合部位が含まれる:
- シグナル配列
- リボソーム, ならびに
- 小胞体の細胞質側膜面のシグナル認識粒子( SRP )受容体 ( ドッキングタンパク質 docking protein とも呼ばれている )
遊離リボソームによって合成されたタンパク質の行き先
シグナル配列なしでタンパク質を合成するリボソームは小胞体に結合しないで,ポリペプチドを合成する。シャペロンも細胞質に存在しており,タンパク質の三次構造を形成するのを助ける。このように合成されたタンパク質にはいくつかの重要な行き先がある:
- 細胞質 において,以下のようなタンパク質として:
- 解糖 系の酵素
- 微小管 をつくるチューブリン
- マイクロフィラメント をつくるアクチン
これらはリボソームから単に離れ,仕事にかかる。
- ミトコンドリア. ミトコンドリアは,自身のゲノム [ ミトコンドリアのゲノム ] とタンパク質合成系を持っているが,ミトコンドリアで利用されるタンパク質のほとんどは,
- 細胞の核の遺伝子によってコード化されており,
- 細胞質で合成され,
- ミトコンドリアに運ばれている。
ミトコンドリアに向かうタンパク質は特徴的なシグナル配列を含んでいる。これは, ミトコンドリア刺激因子 mitochondrial stimulation factor ( MSF ) と呼ばれるシャペロンによって認識され,結合される。 MSF はミトコンドリアの外膜に組み込まれた受容体を標的としている。他の要因ならびに受容体は, 膜間腔 からミトコンドリア内膜 ( たとえば, 呼吸鎖 のあるタンパク質 ) ならびに基質へタンパク質を誘導する。
- 葉緑体 – ミトコンドリアと同様に,葉緑体はそれ自身のゲノム [ 葉緑体のゲノム ] とタンパク質合成系をもつ。
しかし,葉緑体に使われるタンパク質のほとんどは細胞の核の遺伝子によってコード化されており,細胞質のリボソームで合成され,その後葉緑体へ運ばれる。葉緑体へ向かうタンパク質は特異的な配列によって認識される。シャペロンもタンパクの輸送に関わっている。
- ペルオキシソーム – ペルオキシソームへ向かうタンパク質はペルオキシソーム標的シグナル peroxisomal targeting signal ( PTS ) をもっている。これはタンパク質をペルオキシソームへ誘導し,再利用のために戻される受容体分子に結合する。
2 つのペルオキシソーム標的シグナルが同定されている:それぞれが受容体をもっており,ペルオキシソームにタンパク質を誘導する。
| 最初に戻る |
| メニューのページへ戻る |
February 04, 2020