| このページの内容 |
臓器移植
新しい部品としての臓器
今日,人から人へいろいろな器官や組織が移植されている ( この場合を 同種移植 allograft という ) 。ドナーとレピエントが遺伝的に同一な一卵性双子であるという場合はほとんどない。
- 腎臓 kidney
- ドナーが生存の場合,腎臓は 2 つあるが,1 つで暮らしていける。
- 心臓 heart
- 心臓に欠陥 ( たいてい遺伝的な欠陥による ) がある患者に対して行われる。 ( 脳 ) 死者がドナーとなる。
- 肺 lungs
- たいてい心臓と一緒に移植される。生体の肺の一部が移植されることもある。
- 膵臓 pancreas
- インスリン依存性糖尿病 ( IDDM あるいは 1 型糖尿病 ) の患者に対して。
- 肝臓 liver
- 回復不能の肝不全 ( たとえば,毒素や B 型肝炎ウイルス感染によるもの ) 。
- 皮膚 skin
- 火傷に対して;通常患者自身の皮膚が使われる。
- 角膜 cornea
- 視力の回復のために;死体から採取される。
- 血液 blood
- 一時的に血液量を回復させるために。
- 骨髄 bone marrow
- 患者の骨髄に 幹細胞 が移植される。患者は:
- 血球をつくる能力に先天的欠陥がある場合。
例:重症複合型免疫不全 severe combined immunodeficiency ( SCID )
あるいは - ガン治療で造血機能が破壊された場合。
- 血球をつくる能力に先天的欠陥がある場合。
- 患者の骨髄に 幹細胞 が移植される。患者は:
- 臍帯血 cord blood
- 新生児の臍帯から採取された血液;患者の骨髄機能を回復させるための 幹細胞 の豊富な供給源。
問題点
- 拒絶反応
- 患者の免疫系が移植片を異物 ( 抗原性 ) とみなす。 この現象は,細菌が体内に入った場合,生体が細菌を異物 ( 非自己 ) と認め,それを排除しようと免疫反応が生ずるのと基本的に同じである。
- 移植片対宿主病 ( GVHD )
- 移植片の T 細胞 が,レシピエントの組織を外来抗原とみなし,それらに対する免疫の攻撃を仕かける。これは,とくに骨髄移植の際,多量の T 細胞を含むため重大な問題となる。
- 感染症
- 拒絶反応および移植片対宿主病 ( GVHD ) を回避するために免疫反応を抑えるようとすると,伝染性病原 ( 細菌,ウイルス,カビ ) に対する体の抵抗性が低下する。
- ガン
- 宿主の免疫反応を抑制するとガン化する危険性も高まる。
問題点に対する対処
- 可能な場合 ( 皮膚,骨髄,血管 ) 患者自身の組織を使用する。
- 非常にまれな例であるが, “遺伝的に同一” ( 一卵性双子 ) の組織を使用する。遺伝的に同一なので,レシピエントは移植臓器を非自己としてではなく “自己” とみなし,それに対する攻撃を仕かけない。50 年代中頃に行われた腎臓移植の最初の成功例は一卵性双生児間であり,ドナーとレシピエントの両者はその後通常の生活を送っている。
- 拒絶反応が起きにくい部位を使用する。免疫系の攻撃が到達しにくい体の部分がある。角膜 には本来血管がないので,拒絶反応の主役となるリンパ球が到達しにくく,他臓器と比べ,拒絶反応が起きにくい。
- ドナーとして血縁者を選ぶ。兄弟姉妹が望ましい。拒絶反応の強さは,ドナーとレシピエントの移植抗原の差で変わってくる。兄弟は同じ 組織適合抗原 histocompatibility antigen のいくつかを受け継いでいるため,他人の間の移植と比較すると兄弟間の移植が弱い。
- 組織適合試験 – レシピエントとドナー予定者の組織適合性抗原を決定し,よりよい組合せを探す。
- 免疫抑制 – レシピエントの免疫反応を抑えるために免疫抑制剤を用いる。
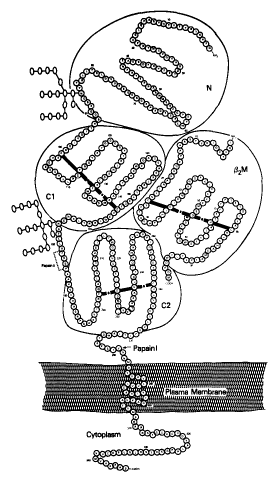
組織適合試験
組織によって発現される最も強い抗原が,クラス I 抗原 と クラス II 抗原 とに大別される組織適合性抗原である。
ヒトの 第 6 染色体 上の遺伝子にコードされている。それらは 主要組織適合 ( 遺伝子 ) 複合体 major histocompatibility complex ( MHC ) と呼ばれる。
| 最近,ヒトの MHC の塩基配列が完全に決定された ( 1999 年 10 月 28 日号のNature ) 。免疫機構に関わる他の多くの遺伝子と同様に,MHC の遺伝子をコード化する第 6 染色体上の 3,673,800 個のヌクレオチドが決定されている。 |
クラス I 抗原 は,以下のものから構成される:
- 膜貫通型タンパク質 に
- b-2 ミクログロブリン分子と
- 短いペプチドが非共有的に結合している。
クラス I 膜貫通型タンパク質は 3 つの遺伝子座: HLA-A, HLA-B, ならびに HLA-C によってコードされている。.
| HLA-A2 分子の模式図 |
クラス I 抗原分子は体のすべての細胞表面で発現する ( 赤血球と中枢神経系の細胞は除く ) 。
クラス II 抗原 は 2 種類の膜貫通型ペプチドから成る:
- alpha ( a ) 鎖 と
- beta ( b ) 鎖 が非共有的に結合している。
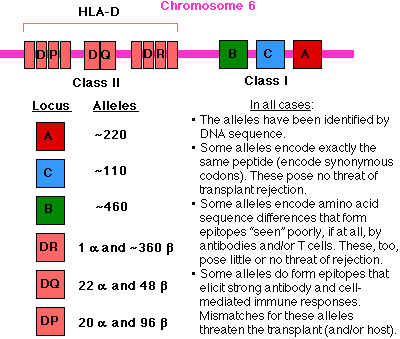 a 鎖と b 鎖は HLA-D と呼ばれる第 6 染色体上にある遺伝子座の一団によってコードされている。
a 鎖と b 鎖は HLA-D と呼ばれる第 6 染色体上にある遺伝子座の一団によってコードされている。
クラス II 抗原は,クラス I 抗原ほど体の中で広く表現しない。しかし,炎症が起こっている細胞はクラス II 抗原を強く発現し,免疫系に強力な刺激を与える。
MHC の遺伝子は最も多い 多型 を示す。右図には,ヒトにおける各遺伝子座の最新の遺伝子数を示す。もちろん,我々は各遺伝子座の 2 つの遺伝子を受け継いでいる。
集団における遺伝子の多様性により,何千もの組み合わせが生じる。
MHC 遺伝子はなぜ多いのか?
クラス I とクラス II 分子の機能は免疫系の T 細胞 へ抗原性ペプチドを認識させることである。このペプチドは,たいてい約 9 個のアミノ酸から成るものであるが,MHC 分子の表面にある溝に非共有的に結合している [ 模式図 ] 。このペプチドが細胞内の侵入者 ( ウイルスなど ) に由来する抗原の断片を含んでいる。
| クラス I の機能を示す模式図 と クラス II の機能を示す模式図 |
- それぞれの侵入者によって,異なる抗原断片が生成される。
- それぞれの MHC 分子によって,これらの断片におけるアミノ酸の特定配列に結合する効率が異なる。
- つまり, MHC 遺伝子産物によって,侵入した抗原を免疫系に認識させる能力が異なる。
ある証拠: ヒト免疫不全症候群ウイルス ( HIV-1 ) に感染した人は,特定の HLA-B 分子を 1 つもっており,他の HLA-B 分子 ( アミノ酸 1 個の違いであっても ) をもつ人より AIDS の発症に抵抗性を示す。
したがって,ヒトのクラス I とクラス II 分子の遺伝子が著しい多様性をもっていることによって,いかなる侵入者 ( ウイルスなど ) によっても集団全体が消滅してしまわないようにするのに役立っている。
組織型解析の技術
ほとんどの組織適合試験は血清学的方法,すなわちこれまで同定されている HLA 抗原にに対する 抗体 を使用して行われる。たとえば,被験者の細胞が 抗-HLA-A28 抗体 と 抗-HLA-A9 抗体 に反応し,他とは反応しない場合,表現型が決定できる。
現時点では,HLA-A, HLA-B, ならびに HLA-DR の表現型を決定するが一般的である。
DNA型解析, とくに HLA-D 抗原に対する DNA 型解析が今後利用されていくだろう。これによって,組織適合性の感度と特異性が向上できる。図 に示した各 HLA 遺伝子座における対立遺伝子の数は DNA 型解析に基づいたものである。
組織型解析はどのように有用なのか?
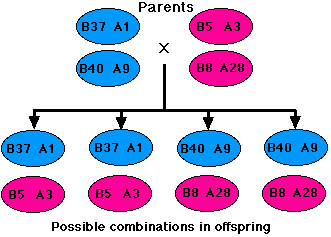
腎臓移植を待つ透析患者にとって,これらのデータはどのような意味を示すのだろうか?
もし患者がドナーとなろうとする家族を多くもっていれば,HLA 座位の 連鎖 性はかなり高いので組織適合性が一致する確率は悪くはない。
母親または父親の 2 本の第 6 染色体の HLA 領域内に 乗り換え が起こらないと仮定すると,彼らの対立遺伝子が子供に遺伝する組み合わせは 4 通りである。両親がそれぞれの遺伝子座に異なる対立遺伝子をもっていたとしても,子供の誰かが他の兄弟と完全に一致する確率は 1/4 である。 〈 ここでは HLA-A と HLA-B 抗原だけが示されているが,HLA 領域の高い連鎖性のために,各染色体のすべての遺伝子座が一団で受け継がれていることが多い。〉
しかし,
- ほとんどの器官は死体から全く血縁のない人に移植される。米国では,全米臓器配分ネットワーク ( UNOS )が計画的に行っている。
- 組織型解析は通常 6 種の HLA 抗原, HLA-A, HLA-B と HLA-DR の各 2 種ずつが検査される。 1 つの遺伝子座に抗原が 1 種だけだと,それは以下のどちらかを意味する:
- その組織は,その対立遺伝子に対して ホモ接合性 である。 または,
- 第 2 の対立遺伝子を検出する抗体が存在しない ( すなわち,未知の遺伝子である ) 。
下の表には数千人の腎臓レシピエントに関する調査結果を示す。
| HLA 不一致の数 | 5 年後の腎臓生存率 % |
|---|---|
| 0 | 68 |
| 1 | 61 |
| 2 | 61 |
| 3 | 58 |
| 4 | 58 |
| 5 | 57 |
| 6 | 56 |
これらから,以下のことが分かる:
- 不一致が全くない場合には,不一致がある場合以上に有利である,ただし小幅である。 ( この有利性は蓄積して,不一致が全くない腎臓の 50% が 17 年後でも機能していたが,不一致が 1 個以上ある場合にはその 50% が 8 年後には失われている。)
- しかし,不一致数が増えても不利益が増大する傾向は小さい。事実,拒絶反応を防ぐ方法が改善されているので,すべての腎臓 ( 遺伝子座がすべて不一致であっても ) の 80% が 1 年目の終わりに機能していると期待できる。
マイナー組織適合性抗原 Minor histocompatibility antigens
MHC のすべての遺伝子座でドナーとレシピエントが一致することは可能であっても,ある組織の非適合性はまだ残るだろう ( 一卵性双子間を除いて ) 。その原因となる抗原はほとんどは同定されていないが,次のものが含まれるだろう:
- H-Y – Y 染色体上にコード化させている抗原。男性 ( 雄 ) の組織に存在するが,女性 ( 雌 ) の組織にはない。
- HA-2 – 収縮タンパク質,ミオシンから生じる抗原。
組織適合性抗原の数と種類から,以下のことが分かる:
- おそらく,完全に組織型が一致する臓器をもつ人 ( 一卵性双子を除く ) は地球上には存在しない。したがって,
- 臓器の移植を成功させるためには,拒絶反応を回避するある程度の 免疫抑制 が必要である。
移植片対宿主病
ドナーの T 細胞 を含んでいる移植片は移植片対宿主病 ( GVHD ) を引き起こすことがある。移植片の T 細胞は異物としてみなされ,宿主の組織に対して広範囲の攻撃を仕かけるように反応する。
GVHD はとくに骨髄 ( すべての 血球 の源 ) と臍帯血の移植で重大な問題となる。ドナーとレシピエントが同一の HLA 対立遺伝子をもっていても,骨髄の移植によって GVHD がしばしば起こる。その理由は,マイナー組織適合性抗原 が異なるためである。
多くのガン患者 ( 白血病,乳ガン ) は放射線および化学療法で処理されるので,ガン細胞だけでなく骨髄も破壊される。生存するためには,そのような治療の後に,骨髄機能を回復させるために幹細胞を移植しなければならない。
- ある場合には,自分自身の 骨髄 が使用される。患者の治療に先立って骨髄が採取され,それに潜在しているかもしれないすべての癌細胞を取り除く。
- 他家骨髄移植が必要な場合,GVHD の危険がある。GVHD が制御できれば,幹細胞は最終的に新しい宿主の骨髄の中に定着し,うまくいけば患者の血球のいちぶ,またはほとんどを生成する。
- 臍帯血 ( 幹細胞の別の供給源となる ) は,重大な GVHD の危険性がやや低い。これは臍帯血が成熟した T 細胞を含んでいないからである。
GVHD の制御 – 拒絶反応の制御と同じで,免疫抑制剤の利用が必要である。
免疫抑制
免疫抑制は患者を免疫反応を抑える薬剤で処理することである。現在用いられている主な薬剤は,以下の通りである:
プリン類縁物質
DNA 合成に用いられる プリン塩基 の類縁物質である。DNA 合成を抑止し,免疫反応に必要な細胞の増殖を妨害する。アザチオプリン Azathioprine ( 商品名イムラン )が最もよく使われている。
| DNA 二重らせん内のプリン塩基 |
この薬剤は活発に増殖する他の組織 ( 腸の上皮,毛包など ) の機能も妨害するので,副作用が大きい。標的細胞に特異的に作用する薬剤の開発が進行中である。
副腎皮質ホルモン
T 細胞が活性化される遺伝子が発現する時に必要な転写調節因子を妨害する。プレドニゾン prednisone と プレドニゾロン prednisolone が最もよく使われている。
FK506 とサイクロスポリン
細菌培養中に分離された天然物質である。遺伝子を活性化するために T 細胞によって用いられる情報伝達系を抑止する。
FK506 はtacrolimus ( 商品名プログラフ ) とも呼ばれる。サイクロスポリン cyclosporine の商品名はネオラル。
ラパマイシン Rapamycin
イースター島で発見された放射菌によって生産されるマクロライド系抗生物質 ( 住民はイースター島を Rapa Nui と呼ぶ。したがってこの命名 ) 。Rapamycin は T 細胞の増殖を抑制する。
Rapamycin は sirolimus とも呼ばれる。商品名は Rapamune。
マイコフェノライト モフェティル Mycophenolate mofetil
この小分子は プリン塩基 合成の時 B 細胞と T 細胞に必要な酵素を抑制する。他の細胞はこの酵素に依存しないので,副作用は軽微。 商品名は CellCept。
抗胸腺細胞グロブリン antithymocyte globulin ( ATG )
これは T 細胞に対する抗体を含む。
モノクローン抗体
現在使用されているもの:
- OKT3 – T 細胞を標的。
- Daclizumab – IL-2 受容体 を標的,したがって,活性化されたT 細胞 のみ抑制。 ( その他多数開発中 )。
免疫抑制の副作用
感染症
免疫反応を全体的に抑えるため,細菌,ウイルスやカビに対する免疫反応も抑えられ,体が無防備状態となる。抗生物質や抗ウイルス剤の投与が必要になる。
ガン
臓器移植を受けた人の 1% から 5% が移植後 2 – 3 年以内にガンになる。これは,大きな数字でないように思われるが,通常の発症率に比べると 100 倍も危険度が増加したことを示す。臓器移植を受けた人はとくにリンパ種,すなわち B 細胞のガンになりやすい。この場合の危険度は 350 倍も高い。
興味深いことに,臓器移植を受けた人には,最も一般的なガンである,肺ガン,乳ガン,大腸ガンならびに前立腺ガンの発症率が増加する傾向はない。
- 一つ例外がある。骨髄移植を受けた人は,これらのガンを発症する危険度がわずかであるが,有意な ( 2 – 3 倍の ) 増加を示す。
何が起きたのか?
この主な原因はこれらの患者が受けた免疫抑制であるように思われる。ほとんどの場合,免疫抑制をやめるとガンの発症は低下する。しかし,移植臓器の拒絶も起こってしまう。
移植腎臓を持つ患者にはその選択は明白である。つまし,彼らは透析の生活に戻ればよく,将来もう 1 つの腎臓を受ける期待が持てる。心臓移植を受けたガン患者はどうであろうか?
臓器移植の将来
臓器移植によって,何千人もの人たちが救われたが,解決されなければならないことがまだ多く残されている。
とくに,以下の 2 点が緊急の課題である:
- 利用できる臓器の数を増やすこと ( 現在でも,需要が供給を超えている )
- 感染症やガン化の副作用がない,拒絶反応を抑制する免疫抑制法を開発すること
この両方の問題に対して,異種移植 xenotransplantation の可能性が期待されている。
異種移植は他の動物の臓器の移植を指す。チンパンジーやヒヒのような霊長類から,心臓,肝臓および腎臓を使用するために多くの試みがなされてきたが,これまではきわめて成功は低い。 1 つの理由は,移植患者の 抗体 によって,異種移植臓器が直ちに攻撃されるという 超急性拒絶 の問題のためである。
しかし,ブタは器官提供動物として実現する可能がある。
その理由は:
- 器官の大きさが人に適した大きさである。
- 以下の問題を回避するための 遺伝子組み換え が可能である:
- 超急性拒絶 – 人が抗体をつくってしまう ( 移植臓器 ) 細胞表面の抗原に関与する遺伝子をノックアウトすることによって可能。
- すべての移植片を拒絶する T 細胞が関与する慢性拒絶を遺伝子組み換えによって回避可能。
- 必要となる数を生産可能である。
しかし,ブタはレトロウイルスをもつ ( ブタ内在性レトロウイルス porcine endogenous retrovirus, PERV と呼ばれる ) 。これらが移植患者に感染する可能性が恐れられている ( 霊長類のレトロウイルスがヒトに種を超えて感染し HIV を形成し,エイズの原因になったように ) 。
これまで,ヒトへのブタの組織の移植は,皮膚や膵島片など極めて限られている。多くの人々は,自らの機能しなくなった脾臓,肝臓,または腎臓に代わってブタ器官あるいはブタ細胞を含む “バイオリアクター” が支援してくれるものとかなり期待している。
これらの移植患者は PERV によって感染していないか監視されなければならないだろう。体外培養されたヒト細胞に PERV が感染したとしても,ブタ組織の移植によってヒトがこのウイルスに感染したという証拠は今のところなにも無い。
免疫的寛容部位
体の特定部位,たとえば:
- 眼
- 精巣
- 脳
は免疫的に特権を持っていることが知られている。つまり,これらの部位は免疫系による攻撃から保護されている。ヒトの角膜移植の成功率が高いのは眼の免疫的寛容性のためである。 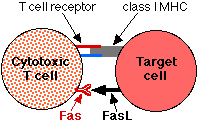 免疫寛容性に関与する要因は,以下の通りである:
免疫寛容性に関与する要因は,以下の通りである:
- 組織中の細胞間が 密着結合 tight junction によって結合している。
- クラス I 組織適合性分子 の発現が低い。
- Fas リガンド, FasL を発現している。
多くの特権のある細胞は,それらの表面上に FasL を発現する。細胞傷害性 T 細胞 によって脅かされた時,細胞は アポトーシス による自殺を選択し,T 細胞に消滅させられるのを回避する。細胞傷害性 T 細胞は,それらの表面上に Fas を発現する。細胞傷害性 T 細胞が,FasLを発現する特権のある細胞に関わろうとした時 ( それらの T 細胞受容体 [ TCR ] に結合した時 ) 目標を殺す代わりに,自らが自殺に追いやられるのである!
ヒトの胎盤も免疫的寛容性を有する。それは母親にとっては夫から移植された腎臓のようにほとんど異物のはずである。しかし,腎臓と違って彼女は ( 9 ヵ月間も!) それを拒絶しない。少なくとも,ラットでは胚と ( 母胎の子宮内膜 ) は 副腎皮質刺激ホルモン放出ホルモン ( CRH ) を分泌する。 このホルモンは胎盤の細胞上に Fas リガンド ( FasL ) を発現するように働く。
活性をもつ T 細胞は Fas を発現している。したがって,標的細胞であるはずの細胞上の FasL に遭遇すると,T 細胞がアポトーシスによる自殺に追いやられてしまうのである。
| アポトーシスによる Fas と FasL についてはこちら ( ただし,その例ではこのページの例と逆になっているので注意して欲しい。つまり,細胞傷害性 T 細胞が自身の FasL を用いて標的細胞を自殺に追いやっている。) |
したがって,遺伝子組み換えブタの器官をヒト FasL が発現するようにすると,おそらく T 細胞が関与する拒絶反応に抵抗性をもつものと考えられる。
| さらに詳しい情報はこちら |
異種移植は安全か?
動物は,しばしばそれらの細胞に潜在するウィルスをもっている。動物細胞が人へ移植された場合,これらのウィルスは患者に感染するのだろうか? そして,新たな伝染病が始まるのだろうか?
他の霊長類からの異種移植の方が危険度はより大きいだろう ( レトロウイルス HIV が霊長類ホストからヒトへ到達したという確かな証拠となるエイズの例がある ) 。
しかし,レトロウイルスはブタでも認められており,ある種のブタレトロウイルスは組織培養で発育しているヒト細胞に感染する。
これらの理由から,異種移植は慎重に行われるべきであると言えるだろう。
| 最初に戻る |
| メニューのページへ戻る |
February 08, 2020